Exames post mortem em primatas não humanos durante epizootia de febre amarela na região metropolitana de Sorocaba, SP, Brasil

Postmortem exams in nonhuman primates during yellow fever
epizootic in Sorocaba Metropolitan Region (RMS), SP, Brazil
Exámenes post mortem en primates no humanos durante una epizootia
de fiebre amarilla en la Región Metropolitana de Sorocaba, SP, Brasil
Clínica Veterinária, Ano XXIII, n. 137, p. 32-42, 2018
DOI: 10.46958/rcv.2018.XXIII.n.137.p.32-42
Resumo: As principais causas de mortalidade em primatas neotropicais são enfermidades virais, bacterianas, parasitárias e traumas. Em todos os casos, necrópsias e exames complementares são essenciais para a determinação da causa mortis do paciente. Durante os meses de maio de 2017 a maio de 2018, 59 primatas não humanos de vida livre ou mantidos sob cuidados humanos de cinco espécies dos gêneros Callithrix, Alouatta e Sapajus foram examinados, sendo o material biológico coletado e enviado ao laboratório do Instituto Adolfo Lutz, em São Paulo. Os exames foram direcionados ao diagnóstico do vírus amarílico, porém, ao longo do período do estudo, outras causas foram diagnosticadas. Os óbitos dos animais foram principalmente provocados por traumas, agressões, arma de fogo, pneumonia, intoxicação por carbamato, febre amarela e por causa indeterminada, durante a epizootia de febre amarela na região metropolitana de Sorocaba.
Unitermos: necrópsia, arbovírus, óbito em primatas, causas de morte, trauma
Abstract: Main mortality causes of neotropical primates are trauma and viral, bacterial and parasitic diseases. In all cases of animal death necropsy, histopathology, and complementary exams are essential to determine the cause of death. Between May 2017 and May 2018, 59 cases of death of non-human primates were registered during the Yellow Fever outbreak in the metro-region of Sorocaba (São Paulo, Brazil). Five species of the genera Callithrix, Alouatta and Sapajus were identified. Wildlife and captivity animals were represented. All biological materials collected during necropsies were submitted to Instituto Adolfo Lutz (in São Paulo, Brazil) to be tested for the Yellow Fever virus. Documented causes of death included Yellow Fever, unspecified trauma, interspecies and intraspecies aggression, firearm-induced trauma, pneumonia, and carbamate toxicosis.
Keywords: necropsy, arboviruses, death in primates, mortality causes, trauma
Resumen: Los principales motivos de muerte de los primates neotropicales son las enfermedades de origen viral, bacterianas, parasitarias y los traumas. En cualquiera de estos casos es importante que se realice una necropsia y exámenes de laboratorio a fin de determinar la muerte del paciente. Entre mayo de 2017 y mayo de 2018 fueron examinados 59 cadáveres de primates no humanos (vida libre y bajo cuidados humanos) de cinco especies de los géneros Callithrix, Alouatta y Sapajus, y el material biológico fue enviado al laboratorio del Instituto Adolfo Lutz en São Paulo, Brasil. El objetivo era comprobar la presencia del virus de la fiebre amarilla, si bien que a lo largo del presente estudio fueron diagnosticadas otras posibles causas de muerte. Los óbitos fueron provocados por traumas, agresiones, armas de fuego, neumonía, intoxicación por carbamatos, fiebre amarilla y, en algunos casos, no se halló la causa de la muerte. Este trabajo se desarrolló durante una epizootia de fiebre amarilla en la región metropolitana de Sorocaba, São Paulo, Brasil.
Palabras claves: necropsia, arbovirus, muerte en primates, causas de muerte, trauma
Introdução
Os primatas não humanos (PNH), nossos parentes biológicos mais próximos, participam ativamente na vida dos seres humanos como meio de subsistência, por meio da cultura, da religião, em algumas sociedades, de estudos da evolução humana, da biologia e do comportamento, e compartilhamos interesses em ameaças de enfermidades emergentes 1. Atualmente, existem 504 espécies de primatas distribuídos em 79 gêneros, nas Américas, na África continental, em Madagáscar e na Ásia; de forma alarmante, cerca de 60% das espécies de primatas do mundo estão ameaçadas de extinção, e aproximadamente 75% estão em declínio populacional 2. Todas as espécies de platirrinos, também conhecidos como primatas do Novo Mundo, naturais das Américas – sul do México, América Central e norte da América do Sul – estão no apêndice II da Convenção sobre Comércio Internacional das Espécies da Flora e Fauna Selvagens em Perigo de Extinção (Cites), e 26 espécies de primatas da fauna autóctone figuram na lista nacional dos animais ameaçados de extinção, comprovando o grau de vulnerabilidade do grupo 3,4.
O Brasil possui enorme variedade de espécies de primatas distribuídos por todo o território nacional. Os bugios-ruivos (Alouatta clamitans – Cabrera, 1940) habitam a região de floresta pluvial e semidecídua do leste do Brasil. A distribuição geográfica se inicia ao norte do Rio de Janeiro, estendendo-se pelo interior de São Paulo, sudeste de Minas Gerais e estados do Paraná, Santa Catarina e Rio Grande do Sul 5. A espécie bugio-vermelho (Alouatta seniculus – Lönnberg, 1941), é encontrada nos estados do Acre e do Amazonas e nos países vizinhos Peru e Colômbia. Ambas as espécies se alimentam de folhas, frutos e flores no dossel superior das matas. O macaco-prego (Sapajus nigrittus – Goldfuss, 1809) ocorre naturalmente nas regiões Sul e Sudeste do Brasil, é característico da Mata Atlântica e tem o hábito alimentar mais variado 6. O sagui-de-tufos-brancos ou mico-estrela (Callithrix jacchus – Linnaeus, 1758) se distribuía desde o estado do Maranhão até o norte do rio São Francisco, limite sul da espécie, ocupando o bioma da caatinga do Nordeste brasileiro. Atualmente a espécie está representada em quase todos os biomas brasileiros, introduzida por seres humanos. O sagui-de-tufos-pretos (C. penicillata – E. Geoffroy, 1812) ocorre naturalmente nos estados de Tocantins, Goiás, norte do Mato Grosso do Sul, parte de Piauí, Bahia, Minas Gerais e norte de São Paulo, e na Região Centro-Oeste brasileira, ocupando o bioma do Cerrado. Os saguis são animais onívoros, alimentando-se de uma gama extensa de itens, com destaque para goma de árvores, insetos, pequenos vertebrados, frutas e frutos 7.
As principais causas de mortalidade de primatas neotropicais podem variar de enfermidades virais, bacterianas e parasitárias a traumas, sendo a realização de necrópsias e exames macro e microscópicos, além de exames complementares, essenciais para a determinação da causa mortis dos animais 8. A febre amarela (FA), caracterizada por uma febre aguda, não contagiosa, de elevada mortalidade, causada por arbovírus da família Flaviviridae, gênero Flavivirus, é uma das doenças infecciosas que podem acometer os primatas neotropicais. A enfermidade é endêmica e enzoótica em regiões tropicais das Américas e da África, e existem registros esporádicos de epizootias, surtos e epidemias de magnitude variável em território nacional 9,10.
No Brasil, são conhecidos dois ciclos de transmissão do vírus da FA: um urbano, com ciclo biológico homem/mosquito/homem, do qual o Aedes aegypti é o principal vetor; e outro silvestre, com ciclo biológico centrado nos primatas não humanos e em mosquitos, podendo envolver também seres humanos, porém com diferentes espécies de mosquitos transmissores, de acordo com a região do país. Os dípteros da família Culicidae estão envolvidos no ciclo silvestre, com importância vetorial dos gêneros Haemagogus e Sabethes, e das espécies H. janthinomys, H. albomaculatus, H. leucocelaenus e S. chloropterus 11. Apesar de o Aedes aegypti estar amplamente disseminado nos estados brasileiros, a transmissão do ciclo urbano da febre amarela não é verificada no país desde 1942; em Sena Madureira, no estado do Acre, foi assinalado o último episódio de febre amarela urbana no país 12.
Os primatas não humanos (PNH) são altamente suscetíveis ao vírus amarílico, amplificando-o durante a fase virêmica e servindo como sentinela, ao sinalizar a circulação do vírus em determinada área. Não existe consenso a respeito da comprovação científica do início ou da manutenção de epizootias, mas é certo que os primatas não humanos, os mosquitos e os seres humanos estão diretamente envolvidos no ciclo de transmissão da febre amarela 13. Nos casos específicos dos bugios (gênero Alouatta), diversos estudos sobre ecologia e comportamento relatam que grandes grupos sociais podem viver em pequenas áreas de mata com menos de 10 hectares. A dieta rica em folhas, de difícil digestão e baixa conversão em energia, caracteriza a espécie como um animal lento e de deslocamento limitado – entre 300 e 800 metros por dia, raramente excedendo mil metros –, que permanece grande parte do dia descansando 14.
Os dípteros, fundamentais na vetoração de enfermidades virais, são considerados o grupo de maior importância em saúde pública, com ênfase nos mosquitos da família Culicidae 15. As espécies de mosquitos do gênero Haemagogus e Sabethes têm alto poder de dispersar enfermidades. Embora algumas espécies conservem hábitos de deslocamento no interior e em dosséis de florestas, eles podem se deslocar no nível do solo para se alimentar de outros mamíferos, inclusive seres humanos. Em áreas de mata degradada, com forte ação antrópica e alta densidade de mosquitos, esse cenário pode ocorrer com mais facilidade 16-18.
Por fim, nossa própria espécie é indicada como o melhor candidato para propagar de forma rápida e eficiente o vírus da febre amarela, devido à facilidade e à rapidez de mobilidade, aliadas à alta proporção de indivíduos assintomáticos – aqueles que desenvolvem formas moderadas ou não diagnosticadas da doença 14. Dados históricos descrevem a febre amarela silvestre (FAS) como enzoótica no Brasil, causando surtos periódicos em seres humanos que vivem próximos às áreas florestais ou em áreas rurais 19. No fim da década de 1990, a epidemiologia da FA expandiu sua fronteira, antes restrita às regiões Norte e Centro-Oeste. A enfermidade foi assinalada nas regiões Sul e Sudeste, causando inúmeros óbitos em primatas não humanos e casos fatais em seres humanos 12.
O deslocamento do vírus da febre amarela para áreas onde a vacina não é recomendada causa enorme preocupação, devido à baixa taxa de cobertura vacinal na população de seres humanos. Grandes epizootias foram notificadas no país nas últimas décadas, com destaque para o estado do Rio Grande do Sul e o norte da Argentina, que, entre 2008 e 2009, diagnosticou a presença do vírus da febre amarela em 69% dos bugios das espécies Alouatta clamitans e A. caraya encontrados mortos, e em 67 municípios da região noroeste do estado 20.
Entre os anos de 2007 e 2009, no norte da Argentina, próximo à divisa com Brasil, exames laboratoriais confirmaram a presença do vírus amarílico, causando óbitos em seres humanos e em primatas do gênero Alouatta, alertando as autoridades sanitárias e indicando uma nova área de ocorrência da enfermidade 21. No estado de São Paulo, também entre os anos de 2007 e 2009, foi identificada a presença do vírus da febre amarela em primatas não humanos. Houve casos positivos do agravo em seres humanos, sendo que o vírus foi identificado nas regiões centro, sul e leste do Estado, áreas de não recomendação vacinal na ocasião da epizootia. O Ministério da Saúde indica as áreas e regiões brasileiras com recomendação de imunização contra febre amarela na população humana, em função da circulação do vírus; após diversos estudos e a confirmação de resultados laboratoriais positivos para febre amarela em 49 municípios do estado de São Paulo, eles foram reclassificados com áreas de recomendação vacinal 22,23.
A partir de 2006, com a publicação da Portaria Ministerial № 5/2006, a vigilância de epizootias em primatas foi incluída na lista de doenças de notificação compulsória como evento-sentinela para a febre amarela, visando à detecção precoce da circulação do vírus e à consequente aplicação das medidas de prevenção antes da ocorrência de casos humanos 24.
Apresentamos a seguir os resultados de necrópsias realizadas na cidade de Sorocaba em primatas não humanos de vida livre e mantidos sob cuidados humanos.
Materiais e métodos
As carcaças de primatas não humanos foram enviadas pelas secretarias municipais dos locais onde os animais foram encontrados, entre maio de 2017 e maio de 2018, em caixas refrigeradas. A época do óbito não coincidia, pois os animais chegavam com históricos individuais e registros com informações variáveis; mesmo assim, tal fato não interferiu nos exames post mortem, e o material biológico foi coletado de todos os animais e enviado ao laboratório.
A recomendação técnica para a realização dos exames post mortem e da coleta de material biológico para pesquisa de febre amarela é que sejam feitos preferencialmente até 24 horas após o óbito do animal – idealmente, 8 horas após. Foram realizados 59 exames post mortem, sendo 52 necrópsias realizadas no Hospital Veterinário da Universidade de Sorocaba (Hovet/Uniso), 5 no Parque Zoológico Municipal Quinzinho de Barros (PZMQB) de Sorocaba e 2 na Divisão de Zoonoses de Sorocaba. Os 52 animais recebidos no Hovet/Uniso e os 5 primatas examinados no Parque Zoológico foram submetidos a exames radiográficos, seguindo o mesmo padrão nas projeções radiográficas.
As necrópsias foram realizadas pelos autores do presente trabalho, independentemente do estado de conservação das carcaças, utilizando a mesma técnica de coleta de material biológico. O protocolo de necrópsia e a coleta de material biológico seguiram as orientações do Guia de vigilância de epizootias em primatas não humanos e entomologia aplicada à vigilância da febre amarela do Ministério da Saúde, 2a edição 10.
A correta identificação das espécies dos símios ficou sob a responsabilidade dos professores da Uniso e de profissionais da rede municipal. A identificação da espécie de alguns primatas estava equivocada na documentação que acompanhava a carcaça e nas fichas do Sistema de Informação de Agravos de Notificação (Sinan)/Ministério da Saúde.
Foram coletadas amostras de tecidos – em tamanho aproximado de 0,5 cm de espessura x 2 cm de comprimento – dos seguintes órgãos: fígado, baço, pulmões, cérebro, coração e rins. A coleta foi feita em duplicata, e as amostras foram acondicionadas individualmente em criotubos estéreis e armazenadas a 20 °C negativos, para isolamento do vírus em cultura de tecidos e identificação de antígenos virais e do RNA viral. Foram coletadas amostras das mesmas estruturas teciduais, com a metodologia descrita anteriormente, para exames histopatológicos e imuno-histoquímicos, conforme protocolo adotado no laboratório de referência, e fixadas em formol tamponado a 10%, mantido em temperatura ambiente. Todas as amostras foram identificadas com as seguintes informações: nome científico da espécie, nome da víscera, data da coleta e número da ficha Sinan.
Todo o material coletado (Figura 1) – ou seja, as 59 amostras de primatas não humanos – foi encaminhado ao Instituto Adolfo Lutz (IAL), em São Paulo, para o diagnóstico de febre amarela, consistindo no material biológico acompanhado da ficha individual de notificação Sinan (Figura 2) e do relatório da necrópsia. Amostras dos tecidos também foram coletadas em álcool 70% para análise geneticomolecular e acondicionadas em temperatura ambiente, segundo recomendação do Centro Nacional de Pesquisa e Conservação de Primatas Brasileiros (CPB).

Resultados e discussão
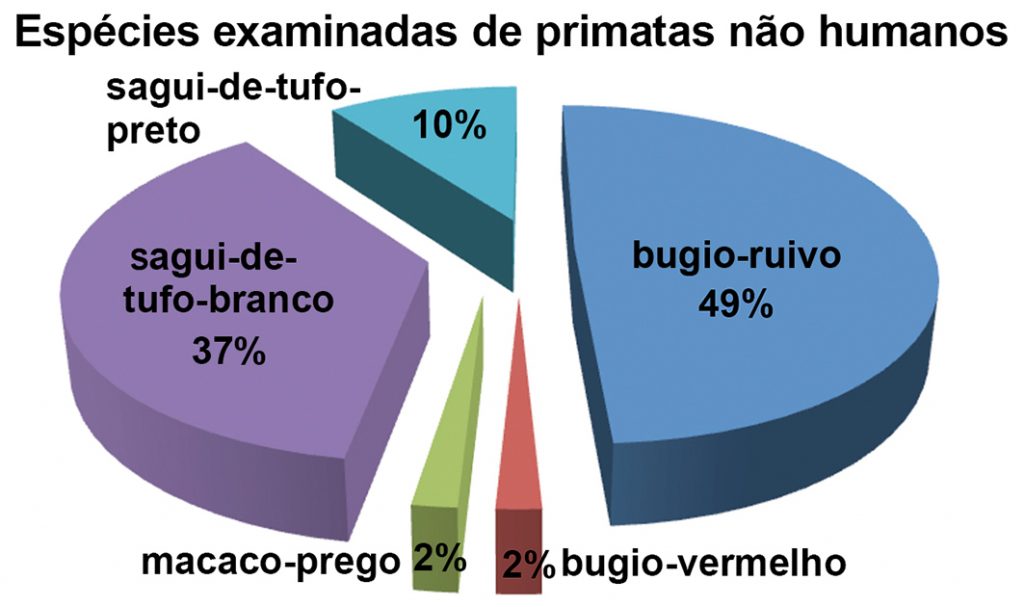
Das 59 carcaças de primatas neotropicais recebidas, 52 apresentavam a pelagem característica das espécies, boa condição corpórea e bom estado de conservação, oferecendo boas condições para a realização de necrópsia; sete delas apresentavam autólise com presença de miíase, uma das quais não oferecia as condições ideais, devido ao adiantado estado de autólise; no entanto, o material biológico foi coletado e enviado ao laboratório. Duas necrópsias foram realizadas no Centro de Controle de Zoonoses e cinco no Parque Zoológico Municipal de Sorocaba, e os demais exames post mortem na Uniso. Dentre os animais examinados, apenas três indivíduos estavam sob cuidados humanos, e os demais eram provenientes de vida livre: sendo 29 (49,15%) bugios-ruivos (A. clamitans), dois oriundos de um mantenedor de fauna silvestre e 27 de vida livre; 22 (37,28%) saguis-de-tufos-brancos (C. jacchus); seis (10,16%) saguis-de-tufos-pretos (C. penicillata); um (1,69%) macaco-prego (S. nigrittus), encontrados em ambiente natural e um (1,69%) bugio-vermelho (A. seniculus), oriundo de uma coleção de animais selvagens mantidos sob cuidados humanos (Figura 3).
Os animais tinham como procedência os municípios de Araçoiaba da Serra, Capela do Alto, Itu, Piedade, Sarapuí, Salto de Pirapora, Sorocaba, Tapiraí e Votorantim, da região metropolitana de Sorocaba; e um indivíduo provinha do município de Pariquera Açu, do Vale do Ribeira, região sul do estado de São Paulo. A causa mortis dos animais se deu em decorrência de traumas, agressões interespecíficas e intraespecíficas, arma de fogo, pneumonia, intoxicação, febre amarela e indeterminada, conforme assinalado na tabela (Figura 4).
| Causa mortis | N | Nome científico | Nome comum | M | F | I | T |
| agressão interespécies* | 5 | C. jacchus | sagui-de-tufos-brancos | 1 | 1 | 0 | 2 |
| A. clamitans | bugio-ruivo | 3 | 0 | 0 | 3 | ||
| agressão intraespécies** | 1 | A. clamitans | bugio-ruivo | 1 | 0 | 0 | 1 |
| arma de fogo | 1 | S. nigrittus | macaco- prego | 1 | 0 | 0 | 1 |
| febre amarela | 13 | C. jacchus | sagui-de-tufos-brancos | 1 | 0 | 0 | 1 |
| C. penicillata | sagui-de-tufos-pretos | 0 | 1 | 0 | 1 | ||
| A. clamitans | bugio-ruivo | 7 | 3 | 0 | 11 | ||
| indeterminado | 16 | C. jacchus | sagui-de-tufos-brancos | 1 | 2 | 0 | 3 |
| C. penicillata | sagui-de-tufos-pretos | 2 | 1 | 0 | 3 | ||
| A. clamitans | bugio-ruivo | 5 | 4 | 0 | 9 | ||
| A. seniculus | bugio-vermelho | 1 | 0 | 0 | 1 | ||
| intoxicação por carbamato | 1 | C. jacchus | sagui-de-tufos-brancos | 0 | 1 | 0 | 1 |
| pneumonia | 2 | A. clamitans | bugio-ruivo | 2 | 0 | 0 | 2 |
| trauma | 20 | C. jacchus | sagui-de-tufos-brancos | 7 | 8 | 0 | 15 |
| C. penicillata | sagui-de-tufos-pretos | 2 | 0 | 0 | 2 | ||
| A. clamitans | bugio-ruivo | 2 | 0 | 0 | 2 |
Figura 4 – Relação de óbitos de primatas não humanos informando causa mortis, número de indivíduos, nome científico, nome comum e sexo dos animais
N – número de animais; M – macho; F – fêmea; I – indeterminado, animal sem identificação do sexo; e T – número total de indivíduos.
* Agressão por animal de outra espécie (cão doméstico).
** Agressão por animal da mesma espécie; jovem agredido por exemplar adulto da mesma espécie.
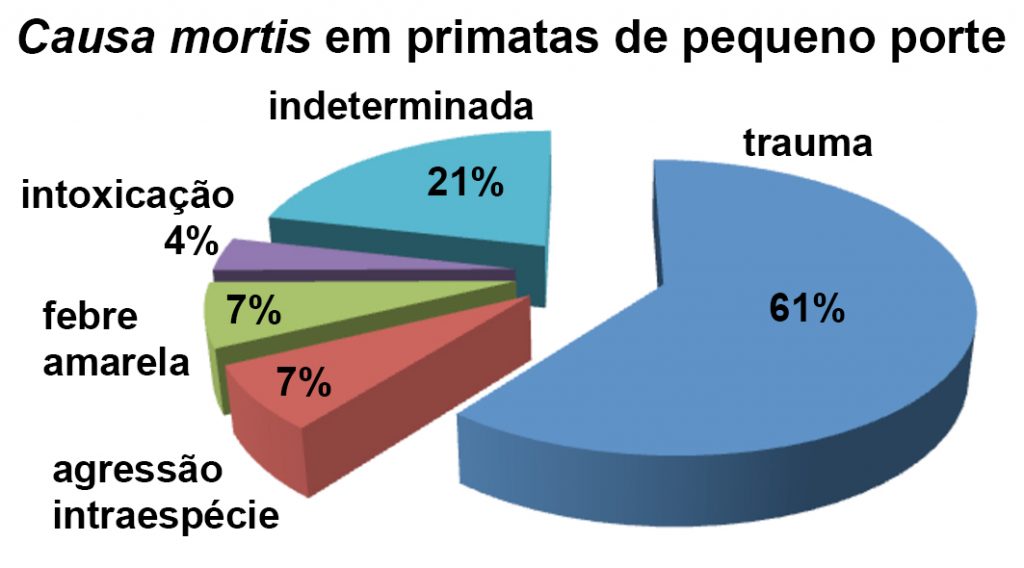
Com o objetivo de apresentar os dados de forma didática, os primatas foram divididos em dois grupos: pequenos primatas – representados pelos saguis-de-tufos-brancos e saguis-de-tufos-pretos; e primatas de médio porte – bugios-ruivos, bugios-vermelhos e macacos-pregos. Os óbitos de 22 saguis-de-tufos-brancos e 6 saguis-de-tufos-pretos analisados, totalizando 28 indivíduos de ambas as espécies, foram provocados por: traumas – 60,71% (17/28); agressão por cão doméstico – 7,14% (2/28); febre amarela – 7,14% (2/28); intoxicação por carbamato – 3,57%(1/28); e causas indeterminadas – 21,42% (6/28) (Figura 5).
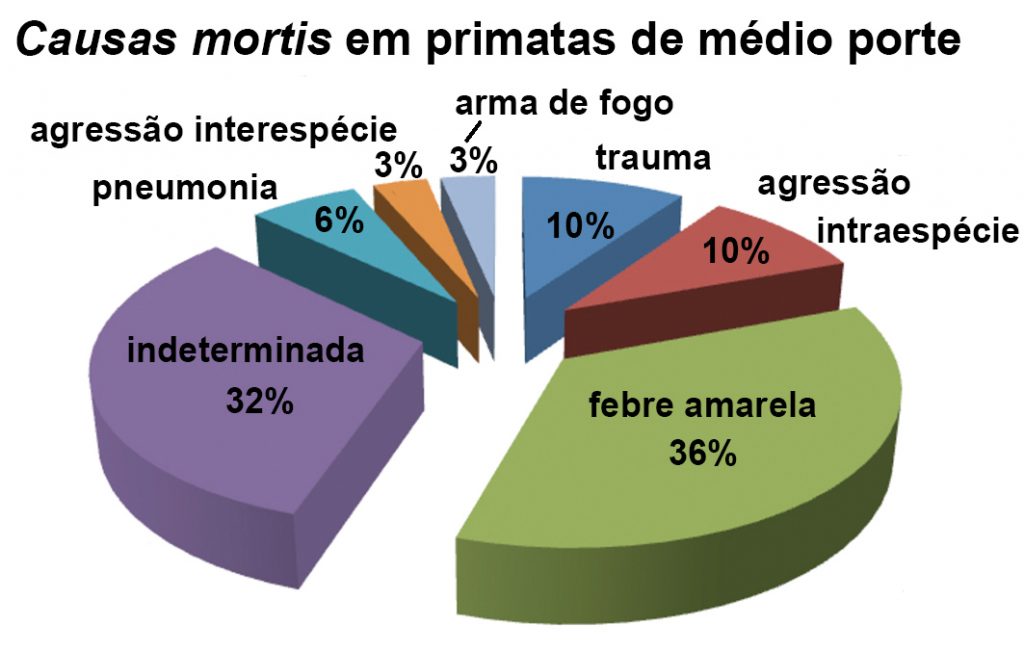
Os primatas de médio porte do gênero Alouatta e Sapajus (n = 31) apresentavam causa mortis provocada por: traumas – 9,67% (3/31); agressão por cão doméstico – 9,67% (3/31); pneumonia – 6,45% (2/31); agressão interespecífica – 3,22% (1/31); arma de fogo – 3,22% (1/31); febre amarela – 35,48% (11/31); e indeterminadas – 32,25% (10/31) das necrópsias realizadas (Figura 6).
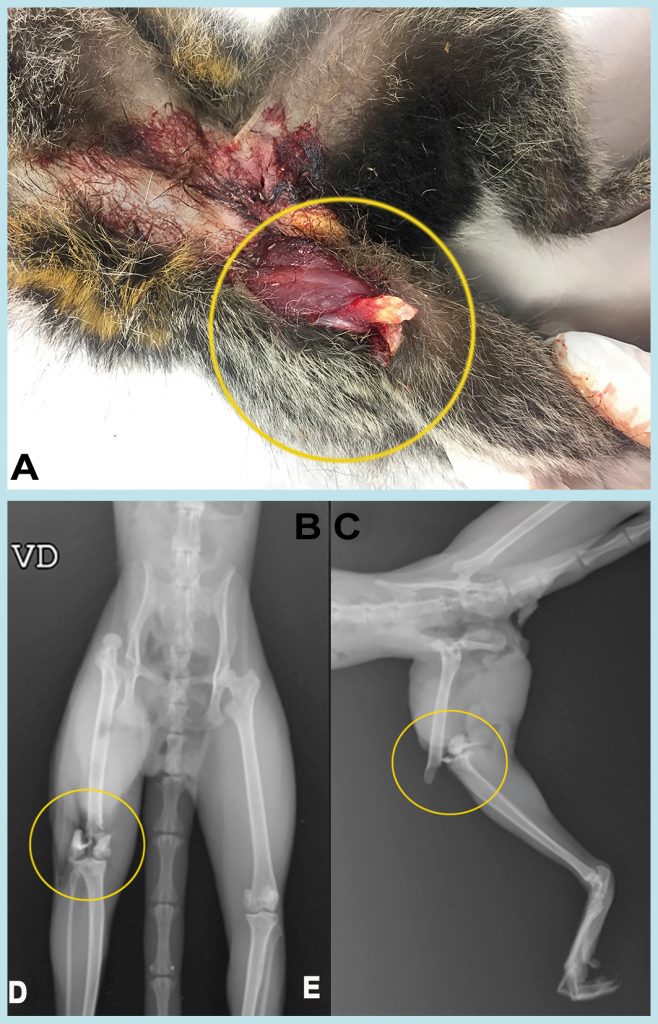
As agressões por cão doméstico foram relatadas nos históricos dos saguis e de bugios-ruivos; nos primatas de pequeno porte, as lesões foram mais marcantes, em extensão e profundidade, sendo evidentes lesões cortocontusas em gradil costal, hematomas subcutâneos, fratura de costelas, lesão de parênquima pulmonar e ruptura de fígado, com fortes hemorragias em cavidades torácicas e abdominais. Assim como ocorreu com os pequenos primatas, foram registradas agressões por cães domésticos em bugios, que apresentavam lesões cortocontusas em região torácica, extremidades e face interna dos membros e cauda, e fraturas completas em costelas e membros; e em um exemplar de bugio, houve a amputação do membro anterior, em função de agressão de cão (Figura 7).

Casos confirmados de agressão interespecífica em ambiente natural são raros, devido à falta do histórico, em função da dificuldade de visualizá-la e por ela se confundir com diversas outras lesões; no entanto, foram encontradas lesões de mordidas na cabeça, em região da face próxima à orelha, aos olhos e ao nariz, características do resultado de agressão entre primatas. Um exemplar macho de bugio-ruivo filhote foi encontrado morto no solo da mata com lesões características de agressão intraespecífica causadas por indivíduos da mesma espécie. Essa situação já foi registrada anteriormente pelo próprio autor, em um grupo de bugios-ruivos de vida livre, possivelmente um método de controle populacional, pois a mata não excede oito hectares, e todos os animais agredidos eram jovens, abaixo de dois anos de vida e do sexo masculino. Situação semelhante já foi descrita por outros autores envolvendo agressões e resultando na morte de animais de vida livre da espécie muriqui-do-sul (Brachyteles arachnoides) no Parque Estadual Carlos Botelho, no estado de São Paulo 25.
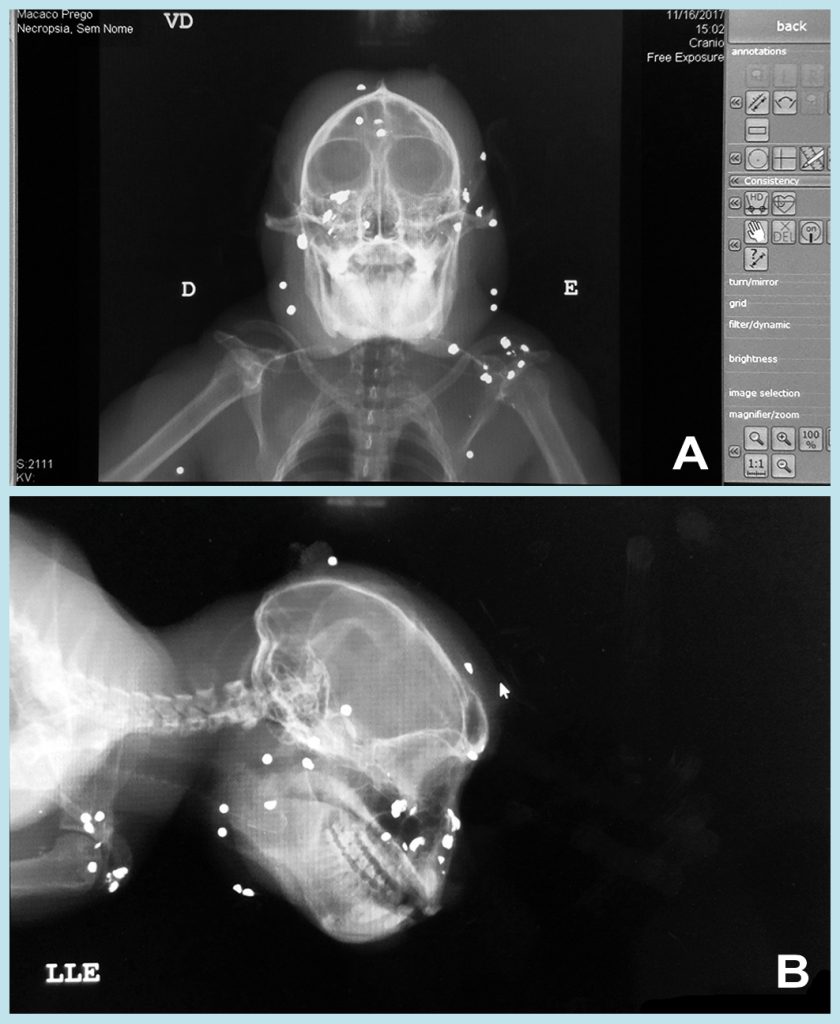
No Brasil, de acordo com a legislação vigente, a caça de animais selvagens não é permitida, mas em certas regiões ainda é possível encontrar animais selvagens abatidos por arma de fogo, fato esse registrado em um indivíduo macho adulto de macaco-prego, oriundo do munícipio de Tapiraí, com a presença de inúmeros fragmentos de chumbos, facilmente visualizados nos exames radiográficos e encontrados em tecido subcutâneo e tecido muscular da região da cabeça, causando hemorragias, pontos de necrose e edemas nos locais de entrada do projétil. O fato foi comunicado ao município de origem do animal, para futuras providências junto às autoridades de fiscalização e combate a crimes ambientais (Figura 8).
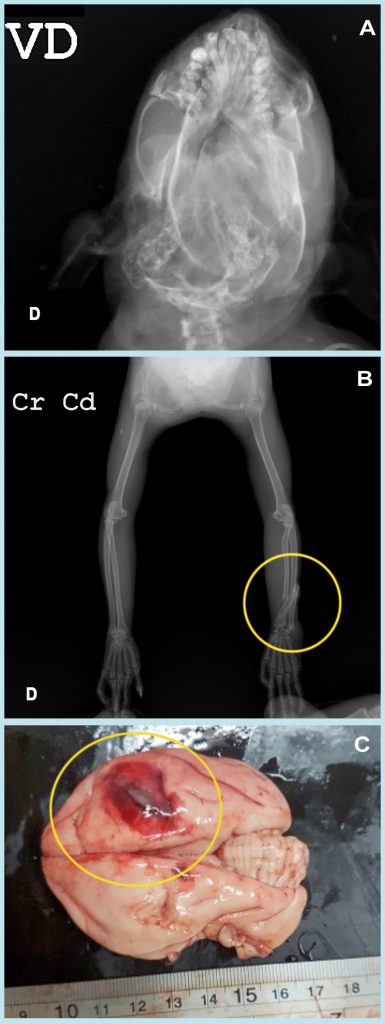
O óbito de 13 animais por febre amarela foi confirmado em exames laboratoriais, sendo 11 bugios-ruivos (Figura 9) – 7 machos, 3 fêmeas e 1 indivíduo de sexo indeterminado –, em razão do adiantado estado de autólise, 1 fêmea de sagui-de-tufos-pretos e 1 sagui-de-tufos-brancos macho. Alguns animais tinham lesões características da enfermidade, apresentando icterícia em mucosas, serosas e em órgãos internos, com destaque para os rins e o fígado; parênquima hepático aumentado de volume e bordos arredondados; baço com tamanho aumentado; e hemorragias em mucosa intestinal com presença de melena. As carcaças de outros exemplares, apesar da confirmação da causa mortis pelo vírus amarílico, não apresentavam lesões marcantes. Um sagui-de-tufos-brancos apresentava discretas lesões macroscópicas visualizadas como leve icterícia em mucosa e serosa, sem alterações hepáticas e esplênicas; e em uma fêmea de sagui-de-tufos-pretos positiva para febre amarela não foram encontradas alterações macroscópicas dignas de nota, apesar do resultado laboratorial positivo.

De um total de 59 exames post mortem, não foi possível determinar a causa mortis de 16 exemplares de primatas – 9 bugios-ruivos, 1 bugio-vermelho, 3 saguis-de-tufos-pretos e 3 saguis-de-tufos-brancos –, devido a autólise da carcaça, razão pela qual os óbitos foram classificados como indeterminados. Os animais eram encaminhados para a necrópsia logo que eram encontrados, e os exames realizados no mesmo dia da recepção das carcaças; porém, não foi possível determinar a data exata do óbito de alguns animais, principalmente dos encontrados em regiões afastadas de centros urbanos, em locais de mata fechada, com pouca circulação de pessoas e de difícil acesso. De qualquer maneira, todos os animais foram submetidos a exames radiográficos, e o material biológico foi coletado, independentemente do estado de conservação da carcaça. Não foi possível determinar o sexo de um exemplar jovem de bugio-ruivo em adiantado estado de autólise, encaminhado com outros seis indivíduos da mesma espécie oriundos do município de Tapiraí.
Em um exemplar de sagui-de-tufos-brancos foi comprovada a presença do produto carbamato, conhecido como “chumbinho”, encontrado em conteúdo estomacal e intestinal, associado ao histórico de morte aguda, assim como severas lesões hemorrágicas em mucosa do trato gastrintestinal, não deixando dúvidas sobre envenenamento. Não foi possível verificar se o fato foi acidental ou intencional.
Dois bugios-ruivos oriundos de uma coleção de animais silvestres tinham histórico de emagrecimento, apatia, febre, perda de apetite e descarga nasal bilateral. As lesões macroscópicas eram características de pneumonia, apresentando edema, enfisema e intensa congestão pulmonar bilateral, com presença de secreção espumosa sanguinolenta em traqueia e brônquios e secreção amarelada em cavidade nasal, com acúmulo de crostas secas nas narinas. Em um trabalho científico, médicos-veterinários de animais selvagens e especialistas em primatas descrevem o caso clínico de um exemplar de sagui-de-tufos-brancos diagnosticado com pneumonia por meio de exame clínico e radiográfico, que foi a óbito pouco tempo após o aparecimento dos sinais clínicos. O resultado da cultura da secreção nasal apontou crescimento de Escherichia coli, e o antibiograma demonstrou resistência do microrganismo a cefalotina e a ampicilina 26. Alguns autores relatam que a pneumonia bacteriana causa alta morbidade e mortalidade em primatas não humanos, e os microrganismos mais frequentemente encontrados em exames de cultura e isolamento bacteriano são do gênero Staphylococcus, Streptococcus, Klebsiella, Pasteurella, Escherichia e Bordetella 3.
As lesões traumáticas que de forma geral acabaram provocando fraturas foram confirmadas por palpação e radiografias em 20 primatas, sendo os mais acometidos os de pequeno porte: saguis-de-tufos-brancos (n = 15) e saguis-de-tufos-pretos (n = 2). As lesões ósseas em primatas de médio porte ocorreram em três exemplares de bugio-ruivo com lesões em região da cabeça (traumatismo em crânio). Não havia diferença significativa entre o sexo dos animais em relação às lesões ósseas. As lesões dos animais se caracterizavam por fraturas simples em membros, traumatismo craniano e fraturas múltiplas, possivelmente causadas por ação antrópica, devido à gravidade. Apesar da ampla divulgação pela mídia de que os primatas não transmitem a febre amarela, muitos animais foram agredidos e mortos, possivelmente por seres humanos (Figuras 10 e 11).
Destaca-se o recebimento de 22 saguis-de-tufos-brancos da região metropolitana de Sorocaba, dos municípios de Araçoiaba da Serra, Capela do Alto, Salto de Pirapora, Sorocaba e Votorantim, provenientes de áreas naturais e considerados de vida livre, comprovando que os animais estão bem adaptados à nova área de distribuição geográfica, apesar de a espécie ser originária da Região Nordeste do Brasil, sendo o rio São Francisco uma barreira física natural.
Assim como o caso do mico-leão-dourado, alguns dos primatas descritos no presente trabalho foram introduzidos em algum momento na região, não encontrando dificuldades para se adaptar. Além de exemplares adultos de machos e fêmeas, encontraram-se animais jovens e subadultos, elementos esses que caracterizam a espécie como invasora (Figura 12). As espécies introduzidas costumam competir com as locais, particularmente por alimentação e território, podendo também introduzir novos patógenos, inclusive aqueles relacionados com doenças humanas 27.

No presente estudo, a carcaça de um sagui-de-tufos-brancos macho, proveniente do município de Capela do Alto, apresentou resultado positivo para febre amarela. Outra carcaça de sagui-de-tufos-pretos fêmea, com origem confirmada do munícipio de Itu, em adiantado estado de autólise, também apresentou resultado positivo para febre amarela, justificando o fato de o material biológico dever ser coletado independentemente do estado de conservação da carcaça.
Considerações finais
Durante o ano de 2017 e começo de 2018, o estado de São Paulo registrou forte epizootia de febre amarela que levou a 950 mortes de primatas não humanos de vida livre. Na região metropolitana de Sorocaba foram confirmados 114 óbitos de primatas por FA.
O presente artigo confirmou o diagnóstico da doença em 13 primatas, correspondendo a 11,40% dos casos positivos na região metropolitana de Sorocaba.
Em seres humanos foram reportados 1.563 casos suspeitos de FA, dos quais foram confirmados 629 (40,2%), sendo 563 autóctones, 62 originados em outros estados e 4 não residentes no estado de São Paulo, porém com local possível de infecção (LPI) dentro do estado de São Paulo. De todos esses casos, houve 214 óbitos, provocando alerta na área de saúde do estado e dos municípios.
Foram realizadas campanhas emergenciais de imunização na população, priorizando áreas rurais das cidades de Ibiúna, São Roque, Mairinque, Araçariguama, Piedade, Votorantim e Pilar do Sul.
No início dos óbitos dos primatas não humanos, a região metropolitana de Sorocaba estava classificada como área indene (sem recomendação de vacina) pelo Ministério da Saúde, fato este que veio a ser modificado ao longo da epizootia (Figura 13).
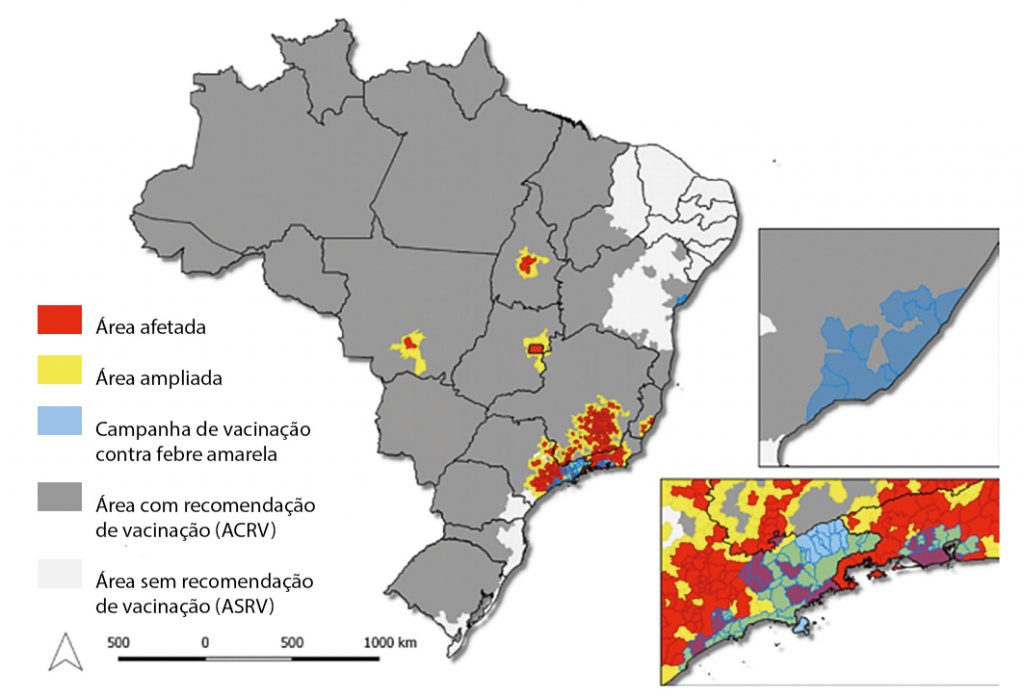
Figura 13 – Áreas com recomendação e sem recomendação de vacinação para febre amarela no território nacional. Em destaque região do estado de São Paulo
Fonte: http://portalms.saude.gov.br/saude-de-a-z/febre-amarela-sintomas-transmissao-e-prevencao/situacao-epidemiologica-dados
Os casos descritos no presente trabalho vêm somar informação pertinente relacionada à presença da febre amarela em diferentes espécies de macacos no município de Sorocaba. Há necessidade de novos estudos para conhecer a causa mortis de macacos no ambiente natural, que contribuirão para o conhecimento da dinâmica das populações desses animais, assim como da relação entre seres humanos e animais selvagens.
Diante das diversas causae mortis que podem ocorrer em primatas não humanos, a necrópsia e a coleta de amostras são procedimentos essenciais para o diagnóstico correto da febre amarela. É imprescindível encaminhar o material biológico a laboratórios de referência em condições adequadas para análise, acompanhado do laudo de necrópsia, da ficha Sinan e, quando possível, de registro fotográfico.
Agradecimentos
Aos servidores do Hospital Veterinário da Uniso (Universidade de Sorocaba) – técnico de radiologia Reinaldo Caetano da Silva, técnico de laboratório Ronnie Von M. Ferreira, biomédico Nilson Santos, coordenadora e professora dra. Ana Carolina Rusca Correa Porto; às alunas do curso de medicina veterinária – Aline Bruder, Ana Laura M. W. Campos, Daiane F. da Silva, Julia V. Ronzani, Marina C. de Souza, Natalia Todesco, Nadine Teixeira Feitosa, Paula Nochelli Prata e Roberta O. M. Aguilar; e aos residentes do Zoológico Municipal de Sorocaba.
Referências
01-ESTRADA, A. ; GAWRBER, P. A. ; RYLANDS, A. B. ; ROOS, C. ; FERNANDEZ-DUQUE, E. ; DI FIORE, A. ; NEKARIS, K. A. I. ; NIJMAN, V. ; HEYMANN, E. W. ; LAMBERT, J. E. ; ROVERO, F. ; BARELLI,C. ; SETCHELL, J. M. ; GILLESPIE, T. R. ; MITWTERMEIER, R. A. ; ARREGOITIA, L . V. ; GUINEA, M. ; GOUVEIA, S. ; DOBROVOLSKI, R. ; SHANEE, S. ; SHANEE, N. ; BOYLE, S. A. ; FUENTES, A. ; MACKINNON, K. C. ; AMATO, K. R. ; MEYER, A. L. S. ; WICH, S. ; SUSSMAN, R. W. ; PAN, R. ; KONE, I. ; LI, B. Impending extinction crisis of the world’s primates: why primates matter. Science Advances, v. 3, n. 1, p. 1-16, 2017. doi: 10.1126/sciadv.1600946.
02-INTERNATIONAL UNION FOR CONSERVATION OF NATURE. IUCN Red List of threatened species. 2017. Disponível em: <https://www.iucnredlist.org/>. Acesso em 20 de janeiro de 2018.
03-VERONA, C. E. ; PISSINATTI, A. Primates – primatas do novo mundo (sagui, macaco prego, macaco aranha, bugio e muriqui). In: CUBAS, Z. S. ; SILVA, J. C. R. ; CATÃO-DIAS, J. L. Tratado de animais selvagens. Medicina veterinária. 2. ed. São Paulo: Roca, 2014. p. 723-743. ISBN: 978-8527726184.
04-CHIARELLO, A. G. ; AGUIAR, L. M. S. ; CERQUEIRA, R. ; MELO, F. R. ; RODRIGUES, F. H. G. ; SILVA, V. M. F. Mamíferos ameaçados de extinção no Brasil. In: PAGLIA, A. P. ; DRUMMOND, G. M. ; MACHADO, A. M. B. Livro vermelho da fauna brasileira ameaçada de extinção. Belo Horizonte: Fundação Biodiversitas, 2008. p. 680-880. ISBN: 978-8577381029.
05-GREGORIN, R. Taxonomia e variação geográfica das espécies do gênero Alouatta Lacépède (Primates, Atelidae) no Brasil. Revista Brasileira de Zoologia, v. 23, n. 1, p. 64-144, 2006. doi: 10.1590/S0101-81752006000100005.
06-LUDWIG, G. ; AGUIAR, L. M. ; ROCHA, V. J. Uma avaliação da dieta, da área de vida e das estimativas populacionais de Cebus nigritus (Goldfuss, 1809) em um fragmento florestal no norte do estado do Paraná. Neotropical Primates, v. 13, n. 3, p. 12-18, 2005. doi: 10.1896/1413-4705.13.3.12.
07-RANGEL, C. H. ; SOUSA, F. S. F. ; GRELLE, C. E. V. Dieta de Callithrix jacchus (Linnaeus, 1758) e Callithrix penicillata (E. Geoffroy, 1812) (Callitrichidae – Primates) e seus híbridos, alóctones no Jardim Botânico do Rio de Janeiro. In:___. MIRANDA, J. M. D. ; HIRANO, Z. M. B. A primatologia no Brasil, 1. ed. Curitiba: UFPR / SBPr, 2011. p. 74-84. ISBN: 978-85-61048-01-3.
08-VANSTREELS, R. E. T. ; TEIXEIRA, R. H. F. ; CAMARGO, L. C. ; NUNES, A. L. V. ; RASSY, F. B. ; NALI, C. ; MATUSHIMA, E. R. Revisão das causas de mortalidade de primatas neotropicais (Primates: Platyrrhini) no Parque Zoológico Municipal Quinzinho de Barros (Sorocaba-SP), 1996-2006. Clínica Veterinária, ano XVI, n. 90, p. 46-52, 2011.
09-LOPES, C. A. A. ; CYSNE, L. B. ; ANDRADE, M. C. R. ; LISBOA, O. A. Agentes infecciosos. In: ANDRADE, A. ; ANDRADE, M. C. R. ; MARINHO, A. M. ; FILHO, J. F. Biologia, manejo e medicina de primatas não humanos na pesquisa biomédica. 1. ed. Rio de Janeiro: Fiocruz, 2010. p. 207-257. ISBN: 978-8575411919.
10-BRASIL. Guia de vigilância de epizootias em primatas não humanos e entomologia aplicada à vigilância da febre amarela. 2. ed. Brasília: Ministério da Saúde, Secretaria de Vigilância em Saúde, Departamento de Vigilância das Doenças Transmissíveis, 2017. 100 p. ISBN: 978-8533421028.
11-ARAÚJO, F. A. A. ; RAMOS, D. G. ; SANTOS, A. L. ; PASSOS, P. H. O. ; ELKHOURY, A. N. S. M. ; COSTA, Z. G. A. ; LEAL, S. G. ; ROMANO, A. P. M. Epizootics in nonhuman primates during reemergence of yellow fever virus in Brazil, 2007 to 2009. Epidemiologia e Serviços de Saúde, v. 20, n. 4, p. 527-536, 2011. doi. 10.5123/S1679-49742011000400012.
12-COSTA, Z. G. A. ; ROMANO, A. P. M. ; ELKHOURY, A. N. M. ; FLANNERY, B. Evolução histórica da vigilância epidemiológica e do controle da febre amarela no Brasil. Revista Pan-Amazônica de Saúde, v. 2, n. 1, p. 11-26, 2011. doi: 10.5123/S2176-62232011000100002.
13-BICCA-MARQUES, J. C. ; FREITAS, D. S. The role of monkeys, mosquitoes, and humans in the occurrence of a yellow fever outbreak in a fragmented landscape in south Brazil: protecting howler monkeys is a matter of public health. Tropical Conservation Science, v. 3, n. 1, p. 78-89, 2010. doi: 10.1177/194008291000300107.
14-BICCA-MARQUES, J. C. How do howler monkeys cope with habitat fragmentation? In: MARSH, L. K. Primates in fragments: ecology and conservation. 1. ed. New York: Kluwer Academic/Plenum Publisher, 2003. p. 283-303. ISBN: 978-1-4757-3772-1.
15-BEATY, B. J. Control of arbovirus diseases: is the vector the weak link? In: PETERS, C. J. ; CALISHER, C. H. Infectious diseases from nature: mechanisms of viral emergence and persistence. 1. ed. Wien: Springer-Verlag/Wien, 2005. p. 73-88. ISBN: 10-3-211-24334-8.
16-MUCCI, L. F. ; MEDEIROS-SOUSA, A. R. ; CERETTI-JÚNIOR, W. ; FERNANDES, A. ; CAMARGO, A. A. ; EVANGELISTA, E. ; CHRISTE, R. O. ; MONTES, J. ; TEIXEIRA, R. S. ; MARRELLI, M. T. Haemagogus leucocelaenus and other mosquitoes potentially associated with sylvatic yellow fever in Cantareira State Park in the São Paulo metropolitan area, Brazil. Journal of the American Mosquito Control Association, v. 32, n. 4, p. 329-332, 2016. doi: 10.2987/16-6587.1.
17-GOMES, A. C. ; TORRES, M. A. N. ; PAULA, M. B. ; FERNANDES, A. ; MARASSÁ, A. M. ; CONSALES, C. A. ; FONSECA, D. F. Ecologia de Haemagogus e Sabethes (Diptera: Culicidae) em áreas epizoóticas do vírus da febre amarela, Rio Grande do Sul, Brasil. Epidemiologia e Serviços de Saúde, v. 19, n. 2, p. 101-113, 2010. doi: 10.5123/S1679-49742010000200003.
18-CARDOSO, J. C. ; ALMEIDA, M. A. B. ; SANTOS, E. ; FONSECA, D. F. ; SALLUM, M. A. M. ; NOLL, C. A. ; MONTEIRO, H. A. O. ; CRUZ, A. C. R. ; CARVALHO, V. L. ; PINTO, E. V. ; CASTRO, F. C. ; NETO, J. P. N. ; SEGURA, M. N. O. ; VASCONCELOS, P. F. C. Yellow fever virus in Haemagogus leucocelaenus and Aedes serratus mosquitoes, Southern Brazil, 2008. Emerging Infectious Diseases, v. 16, n. 12, p. 1918-1924, 2010. doi: 10.3201/eid1612.100608.
19-CÂMARA, F. P. ; GOMES, A. L. B. B. ; CARVALHO, L. M. F. ; CASTELLO, L. G. V. Comportamento dinâmico da febre amarela silvestre no Brasil (1954-2008). Revista da Sociedade Brasileira de Medicina Tropical, v. 44, n. 3, p. 297-299, 2011. doi: 10.1590/S0037-86822011005000024.
20-ALMEIDA, M. A. ; SANTOS, E. ; CARDOSO, J. C. ; FONSECA, D. F. ; NOLL, C. A. ; SILVEIRA, V. R. ; MAEDA, A. Y. ; SOUZA, R. P. ; KANAMURA, C. ; BRASIL, R. A. Yellow fever outbreak affecting Alouatta populations in southern Brazil (Rio Grande do Sul State), 2008-2009. American Journal of Primatology, v. 74, n. 1, p. 68-76, 2012. doi: 10.1002/ajp.21010.
21-MORENO, E. S. ; AGOSTINI, I. ;HOLZMANN, I. ; DI BITETTI, M. S. ; OKLANDER, L. I. ; KOWALEWSKI, M. M. ; BELDOMENICO, P. M. ; GOENAGA, S. ; MARTÍNEZ, M. ; LESTANI, E. ; DESBIEZ, A. L. J. ; MILLER, P. Yellow fever impact on brown howler monkeys (Alouatta guariba clamitans) in Argentina: a metamodelling approach based on population viability analysis and epidemiological dynamics. Memórias do Instituto Oswaldo Cruz, v. 110, n. 7, p. 865-876, 2015. doi: 10.1590/0074-02760150075.
22-MORENO, E. S. ; SPINOLA, R. ; TENGAN, C. H. ; BRASIL, R. A. ; SICILIANO, M. M. ; COIMBRA, T. L. M. ; SILVEIRA, V. R. ; ROCCO, I. M. ; BISORDI, I. ; SOUZA, R. P. ; PETRELLA, S. ; PEREIRA, L. E. ; MAEDA, A. Y. ; SILVA, F. G. ; SUZUKI, A. Yellow fever epizootics in non-human primates, São Paulo state, Brazil, 2008-2009. Revista do Instituto de Medicina Tropical de São Paulo, v. 55, n. 1, p. 45-50, 2013. doi: 10.1590/S0036-46652013000100008.
23-VASCONCELOS, P. F. C. Febre amarela. Revista da Sociedade Brasileira de Medicina Tropical, v. 36, n. 2, p. 275-293, 2003. doi: 10.1590/S0037-86822003000200012.
24-ANVISA. Portaria nº 5, de 21 de fevereiro de 2006. Inclui doenças na relação nacional de notificação compulsória, define doenças de notificação imediata, relação dos resultados laboratoriais que devem ser notificados pelos Laboratórios de Referência Nacional ou Regional e normas para notificação de casos. Diário Oficial da União, 2006.
25-TALEBI, M. G. ; BELTRÃO-MENDES, R. ; LEE, P. C. Intra-community coalitionary lethal attack of an adult male southern muriqui (Brachyteles arachnoides). American Journal of Primatology, v. 71, n. 10, p. 860-867, 2009. doi: 10.1002/ajp.20713.
26-PRIOSTE, F. E. S. ; TEIXEIRA, R. H. F. ; GIOIA-DICHIACCHIO, R. M. Pneumonia por Escherichia coli em sagui do tufo branco, Callithrix jacchus (Linnaeus 1758). In: MIRANDA, J. M. D. ; HIRANO, Z. M. B. A primatologia no Brasil. 1. ed., Curitiba: UFPR/SBPr, 2011. p. 308-313. ISBN: 978-85-61048-01-3.
27-DE MORAIS, M. M. ; RUIZ-MIRANDA, C. R. ; GRATIVOL, A. D. ; DE ANDRADE, C. C. ; LIMA, C. S. ; MARTINS, A. ; BECK, B. B. Os saguis, Callithrix jacchus e C. penicillata, como espécies invasoras na região de ocorrência do mico-leão dourado. In: OLIVEIRA, P. P. ; GRAVITOL, A. D. ; MIRANDA, C. R. R. Conservação do mico-leão-dourado: enfrentando os desafios de uma paisagem fragmentada. 1. ed. Rio de Janeiro: UENF, 2008. p. 86-117. ISBN: 978-85-89479110.
28-BRASIL. Informe nº 19 | 2017 / 2018. Monitoramento do Período Sazonal da Febre Amarela. Ministério da Saúde, 2017 / 2018.
29-GOVERNO DO ESTADO DE SÃO PAULO. Boletim Epidemiológico Febre Amarela. Secretaria do Estado de São Paulo, 2 de Abril de 2018. Disponível em <http://www.saude.sp.gov.br/resources/cve-centro-de-vigilancia-epidemiologica/areas-de-vigilancia/doencas-de-transmissao-por-vetores-e-zoonoses/doc/famarela/fa18_boletim_epid_0204.pdf>. Acesso em 9 de abril de 2018.



