
Introdução
A toxocaríase humana é uma zoonose parasitária negligenciada, com prevalência mundial estimada em 19%, equivalente a aproximadamente 1,4 bilhão de indivíduos 1. Os agentes etiológicos da doença são nematódeos do gênero Toxocara spp., atualmente composto por 26 espécies descritas morfologicamente, sendo T. cati e T. canis as espécies com importância zoonótica 2.
T. canis e T. cati são parasitos que habitam o intestino delgado de cães e gatos (hospedeiros definitivos), respectivamente, com maior prevalência em filhotes de até 1 ano de vida 3. O ciclo de vida do parasito (Figura 1) se inicia com a liberação de ovos nas fezes, que atingem o estágio embrionário no meio ambiente até o desenvolvimento de larva de terceiro estágio 6. Esses animais podem ser infectados por meio da transmissão vertical, pelas vias transmamária e/ou transplacentária 7. Apesar de a via transplacentária estar associada apenas à transmissão de T. canis, recentemente a infecção por T. cati por essa via foi observada em um estudo experimental com ratos 8.
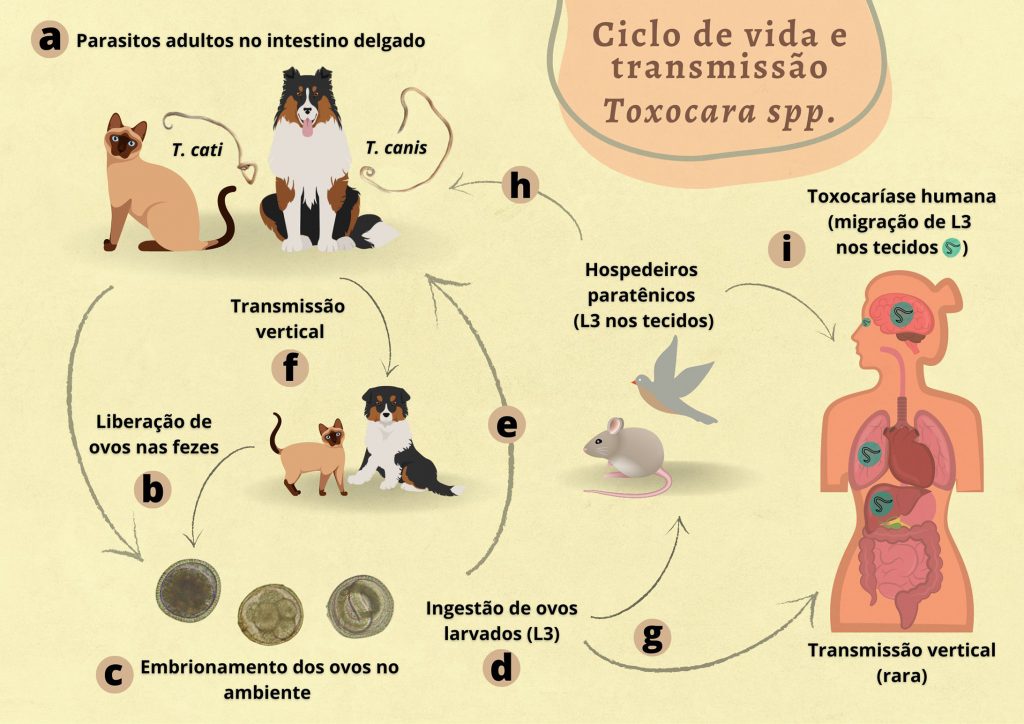
Cães e gatos podem ainda infectar-se por meio da ingestão de ovos larvados (L3) presentes no solo ou de hospedeiros paratênicos (roedores, aves e outros mamíferos) 7,9. Os seres humanos também se comportam como hospedeiros paratênicos, nos quais a L3 não se desenvolve até a forma adulta e migra pelos tecidos 9, o que pode desencadear reações inflamatórias com manifestações clínicas em diferentes graus de gravidade.
As diferentes manifestações clínicas da toxocaríase dependem da localização de migração da larva (Figura 2). A forma assintomática é a mais comum 25, porém existem outras formas da doença, como a visceral (Larva migrans visceral), com acometimento do fígado 10, pulmão 13, rim 14 e coração 15, entre outros; a ocular (Larva migrans ocular), com acometimento do globo ocular 16; e a neurológica, com migração pelo sistema nervoso central 26.
| Formas da doença | Manifestações clínicas |
| Visceral | Febre, icterícia, hepatomegalia, dor e distensão abdominal 10 Linfadenopatia, dor e inchaço articular, cistos hepáticos 11 Dificuldade respiratória e efusão pleural 12 Nódulos pulmonares 13 Síndrome nefrótica 14 Miopericardite e efusão pericárdica 15 |
| Ocular | Diminuição da acuidade visual e leucocoria 16 Descolamento de retina e vasculite retiniana 17 Estrabismo, endoftalmite e granulomas oculares 18 Coriorretinite 19 Exotropia 4 |
| Neurológica | Dor de cabeça, otorreia e otalgia 20 Mielite, disfunção cognitiva e aumento da pressão intracraniana 21 Abscesso cerebral e epilepsia 22 Encefalomielite 23 |
| Assintomática/oculta | Sintomas inespecíficos (tosse, dor de cabeça, dor abdominal) acompanhados de hipereosinofilia e IgE elevada 24 |
Figura 2 – Principais formas da toxocaríase humana e manifestações clínicas
A transmissão da toxocaríase no homem se dá principalmente pela ingestão de ovos embrionados de Toxocara spp. presentes no solo 27. A ingestão de carne crua ou mal cozida 28,29,30 e de frutas e vegetais mal higienizados 31 são outros fatores associados à transmissão da doença.
Contaminação ambiental
A principal fonte de infecção para seres humanos é o solo contaminado por ovos de Toxocara spp. 32. Estima-se que cada fêmea do parasito seja capaz de produzir 200 mil ovos por dia 33, e que cães e gatos (acima de 6 meses de vida) liberam aproximadamente 84.100 ovos por km2 por dia 32.
Locais públicos, como praças, parques e praias, representam uma das principais fontes de infecção humana, uma vez que cães e gatos têm livre acesso a essas áreas, contaminando o solo por meio de fezes. Um estudo de metanálise realizado com solo de locais públicos revelou que 21% das amostras desses locais estavam contaminadas por ovos de Toxocara spp. no mundo 27. Na América do Sul, 25% das amostras resultaram positivas, enquanto o Brasil apresentou prevalência de 30%.
No Brasil, estudos têm mostrado a contaminação do solo por ovos de Toxocara spp. em praças públicas 34,35,36,37, escolas 38,39,40, balneários 41, praias 42,43,44 e ilhas 45. (Figuras 3, 4 e 5).



Importância de T. cati em saúde pública
A maioria das pesquisas científicas com Toxocara spp. tem sido realizada com T. canis, enquanto T. cati tem sido negligenciado 46. A participação de T. cati na cadeia de transmissão tem sido subestimada em relação à de T. canis 32,46,47.
Nos últimos anos, a caracterização molecular de ovos recuperados de amostras de solo tem mostrado maior participação de T. cati na contaminação de ambientes públicos, como em Portugal 48, Polônia 49 e Irã 50. Um dos fatores para a maior contaminação de solo por ovos de T. cati seria o livre acesso de gatos a locais públicos (Figura 6). Além disso, a presença de cercas em locais públicos pode não ser impeditiva para o acesso de gatos a esses ambientes, devido à capacidade de escalada dessa espécie em relação aos cães 51.

Na Inglaterra, os locais com maior densidade populacional de pessoas são os mesmos onde estão localizados o maior número de gatos não domiciliados 52, o que pode facilitar o acesso desses animais a locais de recreação e contaminação ambiental, especialmente em áreas de alta densidade populacional. Além disso, quanto maior o tempo em que os gatos transitam nas ruas, maior o risco de liberação de ovos de T. cati pelas fezes 53.
Além da ingestão de ovos do ambiente, os seres humanos podem se infectar por meio da ingestão de carne crua/mal cozida de hospedeiros paratênicos. Estudos têm mostrado, por meio de técnicas moleculares, a presença de larvas de T. cati em tecidos de hospedeiros paratênicos como avestruz, javali 29, frango 54 e porco 55.
Alternativas para redução da contaminação ambiental por T. cati
Tendo em vista a importância da ingestão de ovos de Toxocara spp. na transmissão da toxocaríase humana, a redução da contaminação ambiental é uma das estratégias fundamentais para o controle da doença.
O tratamento profilático dos filhotes é um dos pontos-chaves para eliminação das larvas transmitidas pela via transmamária (Figuras 7 e 8). A infecção dos filhotes permite a reprodução por parasitos adultos e alta produção de ovos 56, que podem permanecer viáveis no ambiente por até quatro anos, como observado em um estudo realizado na Rússia 57. De acordo com o Conselho Científico Europeu dos Parasitos dos Animais de Companhia (CCEPAC) 58, além da desverminação dos filhotes, recomenda-se o tratamento de gatas gestantes sete dias antes do parto e das lactantes 21 dias após o nascimento dos filhotes. Além disso, em animais que têm acesso à rua, o exame coproparasitológico acompanhado de tratamento anti-helmíntico é recomendado ao menos quatro vezes no ano.
| Filhotes | A partir de 3 semanas de idade, seguido de repetições quinzenais até o desmame, e depois tratamento mensal até os 6 meses |
| Lactantes | Tratamento simultâneo à primeira dose dos filhotes |
Figura 7 – Tratamento anti-helmíntico preventivo para Toxocara cati em filhotes de gatos

A restrição de acesso de animais a ambientes públicos é importante para a redução da dispersão de ovos de Toxocara spp. A instalação de cercas é considerada outra medida importante. Em Fernandopólis, São Paulo, em locais onde não existem, a chance de contaminação por ovos de Toxocara spp. aumentou cerca de 10 vezes 51.
A coleta e a destinação adequada de fezes pode contribuir para a redução das chances de ovos passarem para o estado embrionário no ambiente. Alguns municípios do Brasil vêm adotando a multa para tutores que não recolhem os dejetos dos animais em locais públicos 59.
Portanto, é necessário implantar medidas de controle populacional e divulgar campanhas educativas sobre posse responsável para reduzir o abandono e a circulação de animais sem a supervisão de seus tutores.
Considerações finais
Nas Américas, um estudo de revisão revelou que Toxocara spp. tem sido mais prevalente em gatos do que em cães 3, inclusive no Brasil 60. Os gatos lideram a categoria de maior crescimento da população de animais domésticos no Brasil 61.
T. cati tem sido um parasito subestimado, embora tenha relevância na cadeia de transmissão da toxocaríase humana. Estudos com caracterização molecular de ovos de Toxocara spp. têm mostrado a participação de T. cati na contaminação de espaços públicos em várias cidades do mundo. No Brasil, a contaminação de solo tem sido observada em vários locais (praças, escolas e praias), porém dados sobre a caracterização molecular dos ovos ainda são escassos na literatura, o que constitui uma lacuna no conhecimento sobre o real papel de T. cati na contaminação ambiental no país.
Os métodos sorológicos para pesquisa de anticorpos anti-Toxocara spp. são utilizados para avaliação da ocorrência da infecção pelo parasito em seres humanos, porém a técnica não permite a identificação da espécie envolvida e indica apenas que um indivíduo foi exposto à infecção 45,62,63. Dessa forma, não é possível a identificação da espécie de Toxocara spp. envolvida na infecção das pessoas.
O aumento do trânsito de gatos semidomiciliados ou abandonados em vias públicas pode representar maior risco de contaminação ambiental por T. cati, sendo necessária a adoção de alternativas para redução da contaminação ambiental e para a posse responsável de gatos.
A cobertura de caixas de areia pode evitar que os gatos defequem durante a noite e contaminem esses locais. Além disso, a substituição de caixas de areia por piso de concreto pode facilitar a remoção das fezes e a redução da contaminação ambiental.
É preciso implantar medidas educativas a respeito da toxocaríase, pois a falta de informações sobre T. cati pode fazer que a população não dê a devida importância a exames copropasitológicos e tratamento anti-helmíntico dos gatos, favorecendo a contaminação ambiental e aumentando o risco da infecção em seres humanos.
O médico-veterinário tem papel fundamental na orientação dos tutores sobre a prevenção da toxocaríase (Figura 9), como a realização do tratamento anti-helmíntico, a coleta de fezes dos animais, evitar ingestão de solo e roer unhas, e a higienização das mãos após contato com pets ou material fecal.

Referências
01-ROSTAMI, A. ; MA, G. ; WANG, T. ; KOEHLER, A. V. ; HOFMANN, A. ; CHANG, B. C. H. ; MACPHERSON, C. N. L. ; GASSER, R. B. Human toxocariasis – a look at a neglected disease through an epidemiological ‘prism’. Infection, Genetics and Evolution, v. 74, p. 104002, 2019. doi: 10.1016/j.meegid.2019.104002.
02-ZIEGLER, M. A. ; MACPHERSON, C. N. L. Toxocara and its species. CAB Reviews, v. 14, n. 53, p. 1-27, 2019. doi: 10.1079/PAVSNNR201914053.
03-KETZIS, J. K. ; LUCIO-FORSTER, A. Toxocara canis and Toxocara cati in domestic dogs and cats in the United States, Mexico, Central America and the Caribbean: a review. Advances in parasitology, v. 109, p. 655-714, 2020. doi: 10.1016/bs.apar.2020.01.027.
04-OR, C. ; DAVID, J. A. ; SINGH, M. ; EUSTIS, H. S. ; MAZZULLA, D. A. ; HYPES, S. ; BENEVENTO, J. A rare case of congenitally acquired ocular toxocariasis in a five-week-old infant. Ocular Immunology and Inflammation, v. 29, n. 7-8, p. 1277-1279, 2021. doi: 10.1080/09273948.2020.1866619.
05-CENTERS FOR DISEASE CONTROL AND PREVENTION. Parasites – Toxocariasis (also known as Roundworm Infection). CDC, 2019. Disponível em: <https://www.cdc.gov/parasites/toxocariasis/biology.html>. Acesso em 14 de junho de 2022.
06-ABOU-EL-NAGA, I. F. Developmental stages and viability of Toxocara canis eggs outside the host. Biomédica, v. 38, n. 2, p. 189-197, 2018. doi: 10.7705/biomedica.v38i0.3684 .
07-MA, G. ; HOLLAND, C. V. ; WANG, T. ; HOFMANN, A. ; FAN, C. K. ; MAIZELS, R. M. ; HOTEZ, P. J. ; GASSER, R. B. Human toxocariasis. The Lancet. Infectious Diseases, 18, n. 1, p. e14-e24, 2018. doi: 10.1016/S1473-3099(17)30331-6.
08-OKADA, N. ; OOI, H. K. ; TAIRA, K. Toxocara cati larval migration to mouse fetuses through transplacental infection. Veterinary Parasitology, v. 290, p. 109350, 2021. doi: 10.1016/j.vetpar.2021.109350.
09-STRUBE, C. ; HEUER, L. ; JANECEK, E. Toxocara spp. infections in paratenic hosts. Veterinary Parasitology, v. 193, n. 4, p. 375-389, 2013. doi: 10.1016/j.vetpar.2012.12.033.
10-RITU ; MADHUSUDHAN, K. S. ; MALIK, R. Hepatic visceral larva migrans causing hepatic artery pseudo-aneurysm. Indian Pediatrics, v. 58, n. 2, p. 184-186, 2021. doi: 10.1007/s13312-021-2141-6.
11-DHAYALINI, R. ; DELHIKUMAR, C. G. ; BISWAL, N. Visceral toxocariasis presenting as systemic-onset juvenile idiopathic arthritis. Journal of Tropical Pediatrics, v. 67, n. 3, p. 1-2, 2021. doi: 10.1093/tropej/fmab067. PMID: 34378054.
12-SOUKUP, J. ; CERNY, J. ; CEGAN, M. ; KELBICH, P. ; NOVOTNY, T. Toxocariasis as a rare parasitic complication of a transthoracic spine surgery procedure. Medicina (Kaunas), v. 57, n. 12, p. 1328, 2021. doi: 10.3390/medicina57121328.
13-RANASURIYA, G. ; MIAN, A. ; BOUJAOUDE, Z. ; TSIGRELIS, C. Pulmonary toxocariasis: a case report and literature review. Infection, v. 42, n. 3, p. 575-578, 2014. doi: 10.1007/s15010-014-0587-3.
14-ARDEKANI, A. ; ROSHANSHAD, A. ; HOSSEINI, S. A.; MAGNAVAL, J. F. ; ABDOLLAHI, A. ; ROSTAMI, A. Toxocariasis-associated urinary system diseases: a systematic review of reported cases. Transactions of the Royal Society of Tropical Medicine and Hygiene, trab177, 2021. doi: 10.1093/trstmh/trab177.
15-PARK, S. J. ; JANG, C. W. ; KIM, Y. K. ; SEO, Y. H. ; KIM, K. H. ; KWON, T. G. ; BAE, J. H. Toxocariasis-associated acute perimyocarditis with cardiogenic shock: a case report. American Journal of Case Reports, v. 22, p. e930573, 2021. doi: 10.12659/AJCR.930573.
16-XIE, Y. ; SUN, L. ; CHEN, Y. ; ZHOU, X. ; ZHANG, Z. ; DING, X. Ocular toxocariasis presenting as leukocoria. The Lancet. Infectious Diseases, v. 22, n. 3, p. 426, 2022. doi: 10.1016/S1473-3099(21)00704-0.
17-CAI, Y. ; YANG, Y. ; ZHONG, X. A case report of intravitreal dexamethasone implant with exudative retinal detachment for ocular toxocariasis treatment. The Korean Journal of Parasitology, v. 60, n. 2, p. 133-137, 2022. doi: 10.3347/kjp.2022.60.2.133.
18-MARTINEZ, J. ; IVANKOVICH-ESCOTO, G. WU, L. Pediatric ocular toxocariasis in Costa Rica: 1998-2018 experience. Ocular Immunology and Inflammation, v. 29, n. 7-8, p. 1246-1251, 2021. doi: 10.1080/09273948.2020.1792513.
19-INAGAKI, K. ; KIRMSE, B. ; BRADBURY, R. S. ; MOORTHY, R. S. ; ARGUELLO, I. ; McGUFFEY, C. D. ; TIEU, B. ; HOBBS, C. V. Case report: ocular toxocariasis: a report of three cases from the Mississippi Delta. The American Journal of Tropical Medicine and Hygiene, v. 100, n. 5, p. 1223-1226, 2019. doi: 10.4269/ajtmh.18-0766.
20-SERRANO, M. G. ; RODRIGUEZ-MADRIDEJOS, R. J. ; MENENDEZ, S. M. ; HIDALGO, D. M. H. ; HERNÁNDEZ, J. G. ; MORENO, M. C. I. Toxocariasis affecting brain stem and skull base. BMC Infectious Diseases, v. 21, n. 1242, p. 1-5, 2021. doi: 10.1186/s12879-021-06867-1.
21-LEE, K. P. ; SHEN, P. C. ; SHIH, Y. C. ; CHOU, C. M. ; TSAI, C. S. ; SUN, Y. T. ; FAN, C. K. The first two cases of neurotoxocariasis in Taiwan. Journal of the Formosan Medical Association, v. 120, n. 7, p. 1520-1525, 2021. doi: 10.1016/j.jfma.2021.01.025.
22-BOSSI, G. ; BRUNO, R. ; NOVATI, S. ; MASERATI, R. ; MUSSATI, G. ; GORONE, M. P. ; NEPITA, E. V. ; REGALBUTO, C. ; GOLA, G. ; SIMONCELLI, A. M. ; BRUNO, A. ; MUSSO, P. CLERICI, E. ; MARSEGLIA, G. L. Cerebral toxocariasis as a cause of epilepsy: a pediatric case. Neuropediatrics, v. 52, n. 2, p. 142-145, 2021. doi: 10.1055/s-0040-1721701.
23-HELSEN, G. ; VANDECASTEELE, S. J. ; VANOPDENBOSCH, L. J. Toxocariasis presenting as encephalomyelitis. Case Reports in Medicine, v. 2011, p. 503913, 2011. doi: 10.1155/2011/503913.
24-MAGNAVAL, J. F. ; GLICKMAN, L. T. ; DORCHIES, P. ; MORASSIN, B. Highlights of human toxocariasis. The Korean Journal of Parasitology, v. 39, n. 1, p. 1-11, 2001. doi: 10.3347/kjp.2001.39.1.1.
25-JUÁREZ, X. S. ; DELGADO, M. ; MATTEUCCI, E. D. ; SCHIAVINO, S. ; PASINOVICH, M. E. ; GARCÍA-FRANCO, L. ; CANCELLARA, A. D. Toxocariasis in children: analysis of 85 cases in a paediatric hospital in Argentina. Revista Chilena de Infectologia, v. 38, n. 6, p. 761-767, 2021. doi: 10.4067/s0716-10182021000600761.
26-NICOLETTI, A. Neurotoxocariasis. Advances in Parasitology, v. 109, p. 219-231, 2020. doi: 10.1016/bs.apar.2020.01.007.
27-FAKHRI, Y. ; GASSER, R. B. ; ROSTAMI, A. ; FAN, C. K. ; GHASEMI, S. M. ; JAVANIAN, M. ; BAYANI, M. ; ARMOON, B. ; MORADI, B. Toxocara eggs in public places worldwide – a systematic review and meta-analysis. Environmental Pollution, v. 242, p. 1467-1475, 2018. doi: 10.1016/j.envpol.2018.07.087.
28-GIUDICE, P. A. F. ; LESCANO, S. A. Z. ; GONZÁLES, W. H. R. ; GIUFFRIDA, R. ; BANDEIRA, F. N. ; KMETIUK, L. B. ; SANTOS, A. P. BIONDO, A. W. ; SANTARÉM, V. A. Serosurvey and associated risk factors of anti-Toxocara spp. antibodies in bovines from slaughterhouses of southeastern Brazil. Parasites & Vectors, v. 14, n. 1, p. 250, 2021. doi: 10.1186/s13071-021-04755-w.
29-MICHELUTTI, A. ; SGUBIN, S. ; FALCARO, C. CAGNIN, V. ; ZOROASTER, A. ; DANESI, P. Detection of Toxocara cati larvae from ostrich and wild boar meat intended for human consumption. Pathogens, v. 10, n. 10, p. 1290, 2021. doi: 10.3390/pathogens10101290.
30-HEALY, S. R. ; MORGAN, E. R. ; PRADA, J. M. ; BETSON, M. Brain food: rethinking food-borne toxocariasis. Parasitology, v. 149, n. 1 p. 1-9, 2022. doi: 10.1017/S0031182021001591.
31-BARTOSOVA, B. ; KOUDELA, B. ; SLANA, I. Detection of Cyclospora cayetanensis, Echinococcus multilocularis, Toxocara spp. and microsporidia in fresh produce using molecular methods: – a review. Food and Waterborne Parasitology, v. 23, p. e00124, 2021. doi: 10.1016/j.fawpar.2021.e00124.
32-NIJSSE, R. ; MUGHINI-GRAS, L. ; WAGENAAR, J. A. ; FRANSSEN, F. ; PLOEGER, H. W. Environmental contamination with Toxocara eggs: a quantitative approach to estimate the relative contributions of dogs, cats and foxes, and to assess the efficacy of advised interventions in dogs. Parasites & Vectors, v. 8, n. 397, p. 1-13, 2015. doi: 10.1186/s13071-015-1009-9.
33-DOUGLAS, J. R. ; BAKER, N. F. Some host-parasite relationships of canine helminths. Annals of Biology Colloquium Oregon State College, v. 26, p. 97-115, 1966.
34-SANTARÉM, V. A. ; PEREIRA, V. C. ; PORTO ALEGRE, B. C. Contaminação de praças públicas de Presidente Prudente, São Paulo, Brasil, por ovos de Toxocara spp. Revista Brasileira de Parasitologia Veterinária, v. 21, n. 3, p. 323-325, 2012. doi: 10.1590/S1984-29612012000300029.
35-RIBEIRO, L. M. ; DRACZ, R. M. ; MOZZER, L. R. ; LIMA, W. S. Contaminação do solo em praças de Belo Horizonte, MG, por estádios evolutivos de parasitos de cães. Revista do Instituto de Medicina Tropical de São Paulo, v. 55, n. 4, p. 229-231, 2013. doi: 10.1590/s0036-46652013000400002.
36-QUADROS, R. M. ; LIZ, F. R. ; MARQUES, S. M. T. Ocorrência de ovos de Toxocara spp. em solos de praças públicas de Lages, Santa Catarina. Ars Veterinaria, v. 30, n. 2, p. 109-114, 2014. doi: 10.15361/2175-0106.2014v30n2p109-114.
37-LEE, D. A. B. ; OLIVEIRA, E. L. C. ; LEE, G. A. S. ; SILVA, P. L. ; SANTOS, P. O. M. ; LIMA, V. F. S. Potentially zoonotic parasites in the soil of public squares in the city of Aracaju (Sergipe, Northeastern Brazil). Veterinary Parasitology: Regional Studies and Reports, v. 26, p. 100619, 2021. doi: 10.1016/j.vprsr.2021.100619.
38-OLIVEIRA, B. S. ; RÉDUA, C. R. O. ; SOUZA, Y. S. ; FERNANDES, E. S. Ocorrência de ovos e larvas de helmintos no solo de praças, creches e escolas públicas no município de Luziânia-Goiás, Brasil. Scientific Electronic Archives, v. 8, n. 2, p. 54-58, 2015.
39-MASCARENHAS, J. P. ; SILVA, D. S. Presença de parasitos no solo das áreas de recreação em escolas de educação infantil. Journal of Nursing and Health, v. 6, n. 1, p. 76-82, 2016. ISSN: 2236-1987.
40-MELLO, C. C. S. ; NIZOLI, L. Q. ; FERRAZ, A. ; CHAGAS, B. C. ; AZARIO, W. J. D. ; MOTTA, S. P. ; VILLELA, M. M. Soil contamination by Ancylostoma spp. and Toxocara spp. eggs in elementary school playgrounds in the extreme south of Brazil. Revista Brasileira de Parasitologia Veterinária, v. 31, n. 1, p. e019121, 2022. doi: 10.1590/S1984-29612022003.
41-MERIGUETI, Y. F. F. B. ; FERREIRA, I. B. ; FRANÇA, F. E. ; GARCIA, I. S. ; SOUZA FILHO, R. T. ; SILVA, R. C. ; SANTARÉM, V. A. Contaminação do solo por ovos de Toxocara spp. em balneários de água doce do interior do Estado de São Paulo, Brasil. Brazilian Journal of Health Review, v. 5, n. 3, p.10944-10957, 2022. doi: 10.34119/bjhrv5n3-247.
42-ROCHA, S. ; PINTO, R. M. F. ; FLORIANO, A. P. ; TEIXEIRA, L. H. ; BASSILI, B. ; MARTINEZ, A. ; COSTA, S. O. P. ; CASEIRO, M. M. Análise ambiental do perfil de estruturas parasitárias encontradas no solo arenoso das praias do município de Santos, SP, Brasil. Revista do Instituto de Medicina Tropical de São Paulo, v. 53, n. 5, p. 277-281, 2011. doi: 10.1590/S0036-46652011000500007.
43-LEON, I. F. ; STROTHMANN, A. L. ; ISLABÃO, C. L. ; JESKE, S. ; VILLELA, M. M. Geohelmintos no solo da Laguna dos Patos no Estado do Rio Grande do Sul, Brasil. Brazilian Journal of Biology, v. 80, n. 4, p. 839-843, 2020. doi: 10.1590/1519-6984.222590.
44-FERRAZ, A. ; LIMA, C. M. ; BARWALDT, E. T. ; CASTRO, T. A. ; NOBRE, M. O. ; NIZOLI, L. Q. Contaminação ambiental da areia da Praia do Laranjal, em Pelotas, Rio Grande do Sul, Brasil, por geohelmintos. Ensaios e Ciência – Biológicas Agrárias e da Saúde, v. 26, n. 1, p. 149-152, 2022. doi: 10.17921/1415-6938.2022v26n1p149-152.
45-DELAI, R. R. ; FREITAS, A. R. ; KMETIUK, L. B. ; MERIGUETI, Y. F. F. B. ; FERREIRA, I. B. ESCANO, S. A. Z. ; GONZÁLES, W. H. R. ; BRANDÃO, A. P. D. ; BARROS-FILHO, I. R. ; PETTAN-BREWER, C. ; FIGUEIREDO, F. B. ; SANTOS, A. P. ; PIMPÃO, C. T. ; SANTARÉM, V. A. ; BIONDO, A. W. One Health approach on human seroprevalence of anti-Toxocara antibodies, Toxocara spp. eggs in dogs and sand samples between seashore mainland and island areas of southern Brazil. One Health, v. 13, p. 100353, 2021. doi: 10.1016/j.onehlt.2021.100353.
46-MACIAG, L. ; MORGAN, E. R. ; HOLLAND, C. Toxocara: time to let cati ‘out of the bag’. Trends in Parasitology, v. 38, n. 4, p. 280-289, 2022. doi: 10.1016/j.pt.2021.12.006.
47-FISHER, M. Toxocara cati: an underestimated zoonotic agent. Trends in Parasitology, v. 19, n. 4, p. 167-170, 2003. doi: 10.1016/s1471-4922(03)00027-8.
48-OTERO, D. ; ALHO, A. M. ; NIJSSE, R. ; ROELFSEMA, J. ; OVERGAAUW, P. ; CARVALHO, L. M. Environmental contamination with Toxocara spp. eggs in public parks and playground sandpits of Greater Lisbon, Portugal. Journal of Infection and Public Health, v. 11, n. 1, p. 94-98, 2018. doi: 10.1016/j.jiph.2017.05.002.
49-MIZGAJSKA-WIKTOR, H. ; JAROSZ, W. ; FOGT-WYRWAS, R. ; DRZEWIECKA, A. Distribution and dynamics of soil contamination with Toxocara canis and Toxocara cati eggs in Poland and prevention measures proposed after 20 years of study. Veterinary Parasitology, v. 234, p. 1-9, 2017. doi: 10.1016/j.vetpar.2016.12.011.
50-KAZEMI, F. ; ARJMAND, R. ; FALLAHIZADEH, S. ; TAVALLA, M. Comparison of the detection of Toxocara spp. in the soils of public parks of Ahvaz (Southwest of Iran) by PCR and Loop-Mediated Isothermal Amplification (LAMP). Infectious Disorders Drug Targets, v. 21. n. 3, p. 375-383, 2021. doi: 10.2174/1871526520666200715100433.
51-CASSENOTE, A. J. F. ; NETO, J. M. P. ; LIMA-CATELANI, A. R. A. ; FERREIRA, A. W. Soil contamination by eggs of soil-transmitted helminths with zoonotic potential in the town of Fernandópolis, State of São Paulo, Brazil, between 2007 and 2008. Revista da Sociedade Brasileira de Medicina Tropical, v. 44, n. 3, p. 371-374, 2011. doi: 10.1590/S0037-86822011005000026.
52-MCDONALD, J. L. ; SKILLINGS, E. Human influences shape the first spatially explicit national estimate of urban unowned cat abundance. Scientific Reports, v. 11, n. 1, 20216, 2021. doi: 10.1038/s41598-021-99298-6.
53-NIJSSE, R. ; PLOEGER, H. W. ; WAGENAAR, J. A. ; MUGHINI-GRAS, L. Prevalence and risk factors for patent Toxocara infections in cats and cat owners’ attitude towards deworming. Parasitology Research, v. 115, n. 12, p. 4519-4525, 2016. doi: 10.1007/s00436-016-5242-8.
54-OKADA, N. ; OOI, H. K. ; TAIRA, K. Detection of larvae of Toxocara cati and T. tanuki from the muscles of free-ranging layer farm chickens. Parasitology Research, v. 120, n. 5, p. 1737-1741, 2021. doi: 10.1007/s00436-021-07115-w.
55-DAVIDSON, R. K. ; MERMER, A. ; ØINES, Ø. Toxocara cati larva migrans in domestic pigs – detected at slaughterhouse control in Norway. Acta Veterinaria Scandinavica, v. 54, n. 66, p. 1-3, 2012. doi: 10.1186/1751-0147-54-66.
56-MILLER, A. D. Pathology of larvae and adults in dogs and cats. Advances in Parasitology, v. 109, p. 537-544, 2020. doi: 10.1016/bs.apar.2020.01.024.
57-PAUTOVA, E. A. ; SHCHUCHINOVA, L. D. ; DOVGALEV, A. S. The development and survival of Toxocara canis eggs in the natural climatic conditions of Gorno-Altaisk. Meditsinskaia Parazitologiia I Parazitarnye Bolezni, v. 2, p. 42-44, 2015.
58-EUROPEAN SCIENTIFIC COUNSEL COMPANION ANIMAL PARASITES. Worm control in dogs and cats. 6. ed. Worcestershire: ESCCAP, 2021. ISBN: 978-1-913757-18-2.
59-PEREIRA, K. Ter cãezinhos é legal, sujar a cidade, não. O Tempo, 2019. Disponível em: <https://www.otempo.com.br/opiniao/kenio-pereira/ter-caezinhos-e-legal-sujar-a-cidade-nao-1.2241472>. Acesso em 9 de junho de 2022.
60-DANTAS-TORRES, F. Toxocara prevalence in dogs and cats in Brazil. Advances in Parasitology, v. 109, p. 715-741, 2020. doi: 10.1016/bs.apar.2020.01.028.
61-INSTITUTO PET BRASIL. População pet mundial cresce liderada por gatos. Instituto Pet Brasil, 2021. Disponível em: <http://institutopetbrasil.com/fique-por-dentro/populacao-pet-mundial-cresce-liderada-por-gatos/>. Acesso em 6 de junho de 2022.
62-AZEVEDO, P. O. ; LESCANO, S. Z. ; GIUFFRIDA, R. ; KMETIUK, L. B. ; SANTOS, A. P. DANGOUDOUBIYAM, S. ; BIONDO, A. W. ; SANTARÉM, V. A. Serosurvey of anti-Toxocara antibodies and risk factors in adolescent and adult pregnant women of southeastern Brazil. PLOS Neglected Tropical Diseases, v. 15, n. 8, p. e0009571, 2021. doi: 10.1371/journal.pntd.0009571.
63-ZIBAEI, M. ; SEFIDDASHT, P. K. ; FIROOZEH, F. ; MIAHIPOUR, A. ; BAHADORY, S. Serosurvey of anti-Toxocara antibodies and associated risk factors in domestic dogs and cats owners in Karaj, Alborz Province of Iran. Annals of Agricultural and Environmental Medicine, v. 29, n. 1, p. 50-55, 2022. doi: 10.26444/aaem/146318.







