Pharmacological management of vomiting in feline patients – a review
Manejo farmacológico del vómito en felinos – revisión
Clínica Veterinária, Ano XXV, n. 146 p. 72-85, 2020
DOI: 10.46958/rcv.2020.XXV.n.146.p.72-85
Resumo: O vômito é um reflexo protetor complexo mediado pelo centro emético, região do sistema nervoso central que recebe impulsos provenientes de outras áreas centrais e de aferentes periféricos. Em felinos, a substância P, a serotonina e a noradrenalina são os principais mediadores do vômito, tendo a histamina, a dopamina, a acetilcolina e as encefalinas um papel secundário. Em vista de variações na fisiologia do vômito e na farmacologia entre as espécies, ressalta-se a importância de estudos focados em felinos. Entre os agentes indutores do vômito, os adrenérgicos alfa-2 agonistas, de que são exemplos a dexmedetomidina e a xilazina, são os mais estudados na espécie com essa finalidade. O maropitant e a ondansetrona estão entre os fámacos antieméticos mais recentes. A mirtazapina pode ter utilidade na prevenção do vômito crônico.
Unitermos: medicina interna, gastroenterologia, êmese, farmacologia, terapêutica, gatos
Abstract: Vomiting is a complex protective reflex mediated by the emetic center, a region of the central nervous system that receives impulses from other central and peripheral afferent areas. In cats, substance P, serotonin and norepinephrine are the main mediators of vomiting, with histamine, dopamine, acetylcholine, and enkephalins having a secondary role. In view of variations in the physiology of vomiting and pharmacology across species, the importance of studies focused on felines is emphasized. Among the emetic agents, alpha-2-adrenergic agonists, such as dexmedetomidine and xylazine, are the most studied in the species for this purpose. Maropitant and ondansetron are the more recent antiemetic drugs. Mirtazapine may be useful to prevent chronic vomiting.
Keywords: internal medicine, gastroenterology, vomiting, pharmacology, therapeutics, cats
Resumen: El vómito es un reflejo protector complejo mediado por el centro del vómito, una región del sistema nervioso central que recibe impulsos de otras áreas centrales y periféricas aferentes. En los gatos, los principales mediadores de la emesis son la sustancia P, la serotonina y la noradrenalina, mientras que la histamina, la dopamina, la acetilcolina y las encefalinas cumplen un papel secundario. Teniendo en cuenta que la fisiología y la farmacología del vómito varían de acuerdo a las diferentes especies, cabe resaltar la importancia de ciertos estudios realizados en felinos. Entre los agentes inductores del vómito más estudiados en felinos están los adrenérgicos alfa-2 agonistas como dexmedetomidina y xilacina. El maropitant y el ondansetron se encuentran entre los fármacos más recientemente introducidos. La mirtazapina puede ser útil en la prevención del vómito crónico.
Palabras clave: medicina interna, gastroenterología, emesis, farmacología, terapéutica, gatos
Introdução
O vômito é um dos sintomas mais comuns na clínica de felinos. Pode ser definido como um reflexo protetor por meio do qual se promove um fluxo retrógrado de conteúdo gastrintestinal com vistas à sua expulsão do organismo. De natureza aguda ou crônica (mais de 2-3 semanas de evolução) 1-2, o vômito pode estar associado a uma grande variedade de enfermidades de origem digestória (doença intestinal inflamatória, linfoma, pancreatite, lipidose hepática, colângio-hepatite, entre outras), metabólica (uremia, insuficiência hepática), sistêmica (sepse, falência múltipla de órgãos), endócrina (hipertireoidismo, cetoacidose diabética) ou medicamentosa 3-5. Sendo assim, a determinação de sua causa depende de uma avaliação clínica criteriosa baseada na anamnese, no exame físico e, quando necessário, em exames complementares.
Quando se fala sobre o vômito, em geral a principal preocupação clínica se refere ao controle e à prevenção. No entanto, pode haver raras situações em que a indução é desejável. O objetivo desta revisão é abordar os mecanismos patofisiológicos do vômito na espécie felina e os principais fármacos indicados para a sua indução, o seu controle e a sua prevenção.
Fisiologia do vômito
A ocorrência do vômito depende da estimulação de uma área localizada na formação reticular lateral do tronco cerebral chamada centro emético (CE) 6. Essa área, protegida do contato com o sangue circulante pela barreira hematoencefálica, é responsável por gerar toda a sequência de eventos gastrointestinais: contrações duodenais e gástricas retrógradas, relaxamento do esfíncter gastroesofágico, refluxo gastroesofágico e abertura do esfíncter esofágico superior, assim como a contração da musculatura abdominal e torácica que culminam com a expulsão de conteúdo 3,4,6,7.
Apesar da referência ao CE como uma área bem definida do tronco encefálico em felinos, um estudo falhou em identificar o que se poderia chamar de um “centro” neuronal verdadeiro, uma vez que a atividade neuronal relacionada ao vômito parecia ser difusa 8. Por fins didáticos e para facilitar o entendimento, o termo “centro emético (CE)” continuará sendo utilizado nesta revisão. Contudo, o CE depende do recebimento de impulsos nervosos provenientes de algumas áreas adjacentes a ele para desencadear o vômito, como a zona de gatilho (ou deflagradora) dos quimiorreceptores e o córtex cerebral. Além disso, impulsos provenientes de vias periféricas também podem estimular o CE (Figura 1) 3,6,9.
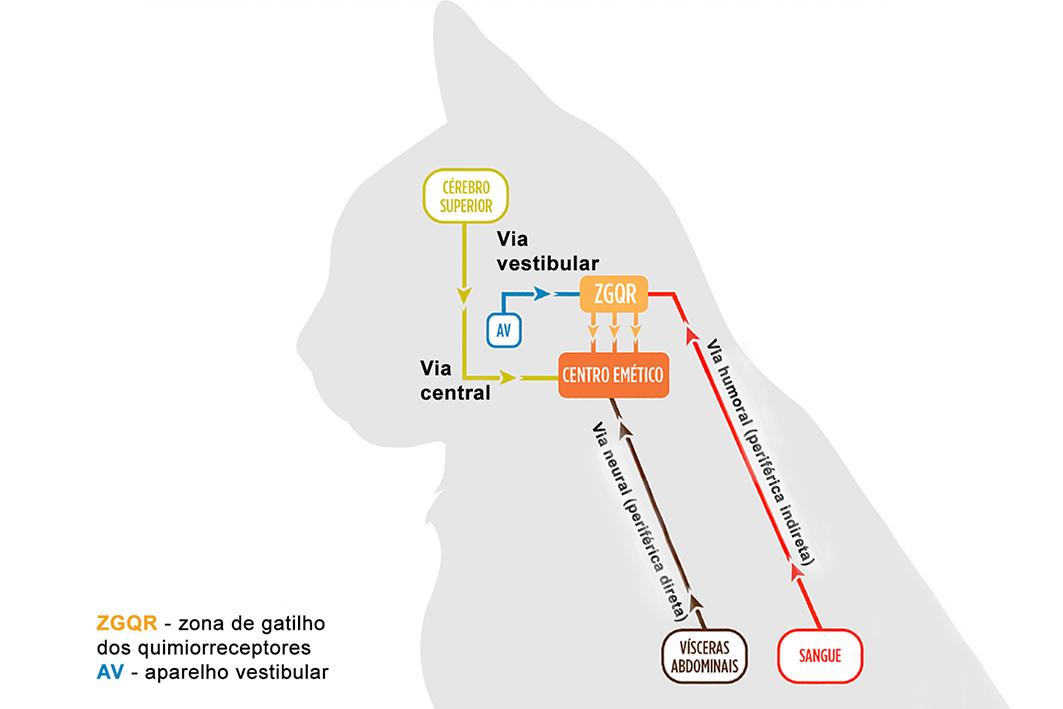
A zona de gatilho dos quimiorreceptores (ZGQR) situa-se fora da barreira hematoencefálica, na área postrema do tronco encefálico 3. Altamente vascularizada, essa área tem contato com substâncias presentes no sangue periférico que podem provocar a ativação de receptores envolvidos na origem do vômito. Entre as substâncias que sabidamente iniciam o reflexo do vômito na ZGQR estão: ureia, amônia, endotoxinas, corpos cetônicos, opioides, quimioterápicos, agentes alfa-2 agonistas e eletrólitos, entre outros 2,4,5. Em sequência, a ZGQR estimula por via neural o CE, que desencadeia o vômito. Essa via de estimulação do vômito é conhecida como via humoral ou, alternativamente, como via periférica indireta, uma vez que a estimulação do CE depende da ativação prévia da ZGQR. Impulsos nervosos provenientes do córtex cerebral igualmente são capazes de acionar o CE de maneira direta. Exemplos de situações clínicas em que o córtex cerebral pode iniciar o vômito (via central direta) na medicina humana incluem ansiedade, medo, dor e trauma 10,11. Especula-se que o mesmo possa ocorrer em gatos, apesar da escassez de literatura sobre o assunto. Por fim, impulsos periféricos decorrentes de distensão ou irritação de órgãos e tecidos viscerais (estômago, intestino delgado, fígado, vesícula biliar, peritônio, rins, ureteres, bexiga e útero) caminham por nervos aferentes simpáticos ou vagais para estimular o CE 6. Tal via é conhecida como via neural do vômito ou periférica direta (Figura 1).
Além de captar informações provenientes do sangue periférico, a ZGQR pode ser ativada pelo aparelho vestibular. Impulsos eméticos provenientes dos canais semicirculares da orelha interna são transmitidos para a ZGQR e então para o CE; o vômito de origem vestibular está associado a condições clínicas como labirintite e enjoo do movimento 3,6,9.
Neurotransmissores envolvidos no vômito
Em cada uma das vias descritas anteriormente (humoral, central, neural e vestibular), pode haver a presença de um ou mais neurotransmissores capazes de estimular o vômito em felinos. Considera-se que os mediadores adrenérgicos, a histamina, a serotonina, a acetilcolina e a substância P são os mais importantes na regulação 9.
No CE, encontram-se receptores de serotonina (5-HT3 e 5-HT1), dopamina (D2), substância P (receptor de neurocinina do tipo 1 – NK1) e alfa-2 adrenérgicos (noradrenalina) 3,6. Na ZGQR, uma ampla variedade de receptores pode ser observada – 5-HT3, D2, NK1, muscarínicos do tipo 1 (M1 – acetilcolina), receptores de encefalinas, alfa-2 adrenérgicos e, com um papel secundário, receptores de histamina do tipo 1 (H1) 3,6,9. No aparelho vestibular, os receptores envolvidos na origem do vômito são principalmente M1 e H1, tendo os receptores serotoninérgicos e adrenérgicos relevância menor 9. Receptores M1 periféricos são encontrados nas vias aferentes vagais de vários órgãos abdominais e podem iniciar o vômito pela via periférica direta (neural) 6. Particularmente no trato gastrintestinal, a serotonina desempenha um papel importante na iniciação do vômito; nas vias aferentes de estômago e intestino existe uma quantidade significativa de receptores 5-HT3 3,6,9. A figura 2 sumariza os principais receptores encontrados em cada área.
| Área | Receptor | Neurotransmissor |
| Centro emético (CE) | 5-HT3 e 5-HT1 D2 NK1 Alfa-2 adrenérgicos |
Serotonina Dopamina Substância P Noradrenalina |
| Zona de gatilho dos quimiorreceptores (ZGQR) | 5-HT3 D2 NK1 M1 ENK Alfa-2 adrenérgicos H1 |
Serotonina Dopamina Substância P Acetilcolina Encefalinas Noradrenalina Histamina |
| Aparelho vestibular | M1 H1 |
Acetilcolina Histamina |
| Trato gastrintestinal | 5-HT3 M1 |
Serotonina Acetilcolina |
Figura 2 – Principais receptores e neurotransmissores envolvidos na fisiologia do vômito 3,6,9.
5-HT – 5-hidroxitriptamina (= serotonina); NK1 – receptores de neurocinina do tipo 1; ENK – receptores de encefalina
Abordam-se a seguir os estudos de eficácia e segurança de fármacos para manejar o vômito na espécie felina. A figura 3 sumariza os principais agentes emetogênicos e antieméticos e suas doses para felinos.
| Fármacos | Doses |
| Indutores do vômito (emetogênicos ou eméticos) | |
| Dexmedetomidina | 5 a 10 µg/kg, IM 17,27,32 |
| Xilazina | 0,36 a 0,66 mg/kg, IM 17,20,26,27 |
| Morfina | 0,1 mg/kg, IM 19,31 |
| Antieméticos | |
| Maropitant | 1 mg/kg, IM ou SC, 24/24 h 20,56 |
| Ondansetrona | 0,5 a 1 mg/kg 30 minutos antes da utilização de quimioterápicos 9 0,5 a 1 mg/kg, SC ou oral, 12/12 h 9,40,42,43 |
| Mirtazapina | 1,88 mg/animal, oral, 24/24 h 9,42 Doença renal crônica: 1,88 mg/animal, 48/48 h 58,62 |
Figura 3 – Principais agentes emetogênicos e antieméticos com suas doses para felinos
Indutores do vômito (emetogênicos ou eméticos)
A indução do vômito pode ser indicada em casos de pacientes assintomáticos com ingestão recente (< 1 h) ou tardia de intoxicantes ou quando o elemento ingerido permanece por longo tempo no estômago (chocolates, uvas-passas, chicletes com xilitol, uvas); porém, a indução nunca deve ser utilizada em pacientes com sintomas (tremores, agitação, convulsões, febre, hipoglicemia, fraqueza), nos casos de intoxicantes corrosivos ou se o paciente apresenta condições que favoreçam a aspiração de conteúdo, como megaesôfago, paralisia de laringe e histórico de pneumonia por aspiração 12,13.
Peróxido de hidrogênio
O peróxido de hidrogênio a 3% (“água oxigenada”) pode ser utilizado em cães como agente indutor de vômito, sob a orientação de um médico-veterinário, quando o transporte imediato a uma clínica ou a um hospital veterinário não é possível 14. Seu efeito antiemético é rápido – em torno de 10 a 15 minutos – e deve-se a uma estimulação direta, devido ao efeito irritativo provocado na mucosa gástrica e na orofaringe 13,14. Um estudo realizado com 147 cães com diagnóstico de intoxicação demonstrou que o peróxido de hidrogênio a 3% (2,2 mL/kg, volume máximo de 45 mL/animal) foi tão eficaz quanto a administração de apomorfina (0,03 mg/kg por via intravenosa ou instilada no saco conjuntival após diluição em solução salina), com taxas de sucesso de 90% e 94%, respectivamente 15. Contudo, um estudo mais recente com avaliação endoscópica e histopatológica de cães apontou lesões gástricas importantes nas primeiras 24 h em todos os animais que receberam o peróxido de hidrogênio, não havendo lesões nos que receberam apomorfina 16. Apesar de as lesões regredirem após 2 semanas de administração, esse último estudo aponta que o peróxido de hidrogênio pode não ser tão inofensivo.
Em felinos, o peróxido de hidrogênio a 3% foi utilizado na dose de 1,5 a 2 mL/kg para tentar induzir o vômito em apenas três animais, mas sem sucesso 17. Além disso, considera-se o peróxido de hidrogênio contraindicado para a espécie felina, tendo em vista sua baixa eficácia e o risco de sialorreia, gastrite hemorrágica e hematêmese prolongada 13.
Agentes adrenérgicos alfa-2 agonistas (xilazina e dexmedetomidina)
Os agentes alfa-2 agonistas são utilizados há muito tempo em medicina felina como analgésicos, sedativos e relaxantes musculares 18. O mecanismo pelo qual os efeitos citados são desencadeados está fora do escopo desta revisão. Contudo, a capacidade de a xilazina e a dexmedetomidina induzirem o vômito é conhecida desde o início de sua utilização clínica, a ponto de ambas serem empregadas como indutores nos estudos de eficácia de antieméticos 19-21. Elas são agonistas de receptores alfa-2 adrenérgicos contidos na ZGQR, gerando o vômito pelas vias humoral ou periférica indireta 22,23. Porém também se atribui a elas um mecanismo de estimulação do vômito por receptores alfa-2 adrenérgicos centrais, possivelmente contidos no CE 24-25.
As doses de xilazina indicadas para induzir o vômito em felinos variam de 0,36 a 0,66 mg/kg, geralmente pela via intramuscular 17,20,26,27. A dose de 0,44 mg/kg é citada em dois estudos 17,20 e aparece dentro da faixa utilizada em uma outra abordagem 27 – uma possível referência inicial para o seu uso. Após a administração de xilazina, a ocorrência do vômito geralmente se dá logo em seguida, de 1 a 10 minutos depois, embora alguns animais apresentem vômito tardio, em 20 a 175 min, ou mesmo não vomitem 17,26,27. As taxas de sucesso são razoáveis, variando de 43% a 44% 17,27 segundo os diferentes autores. Em que pese não haver estudos formais avaliando se a dose pode ter relação com o efeito emetogênico, a análise comparativa de animais que receberam mais ou menos que 0,44 g/kg de xilazina não demonstrou diferença de eficácia 27.
A dexmedetomidina apresenta maior seletividade para receptores alfa-2 adrenérgicos, sendo cerca de 10 vezes mais seletiva para receptores alfa-2 que para alfa-1 em relação à xilazina 18. Do ponto de vista terapêutico, isso representa uma vantagem, uma vez que a sedação e a analgesia dependem da ação em alfa-2, e os efeitos em alfa-1 favorecem a ocorrência de arritmias 28,29. Doses de 7 a 40 µg/kg de dexmedetomidina mostraram-se capazes de provocar o vômito em diversos modelos de estudos experimentais em gatos, nos quais foi avaliada a eficácia de diferentes antieméticos 17,19,21,30-32. Com doses de 20 a 25 g/kg de dexmedetomidina pela via intramuscular, as taxas de sucesso de indução foram de 79% a 71%, respectivamente (sem diferença estatística), com vômitos observados em um tempo médio de 3,45 min (±1,65 in) 30. Curiosamente, em dois estudos que utilizaram dexmedetomidina (20 µg/kg) e morfina (0,1 mg/kg) como indutores ao mesmo tempo, as taxas de sucesso não foram superiores às citadas anteriormente, sendo de 32% 31 e 59% 19 respectivamente. Além disso, doses inferiores a 20 µg/kg também se mostraram eficazes: 0,96 a 10 µg/kg 17, 6 a 18 g/kg 27 e 10 µg/kg 32, com taxas de sucesso de 81%, 58% e 76-85%, respectivamente, em cada estudo. No estudo em que a faixa de 6 a 18 g/kg foi empregada, não houve diferença na frequência de vômitos entre os animais que receberam mais ou menos que 10 µg/kg.
Quando a xilazina e a dexmedetomidina foram empregadas no mesmo estudo, observou-se diferença na taxa de indução. Em uma abordagem, 44% dos gatos que receberam xilazina (0,4 a 0,5 mg/kg, IM) e 81% dos animais tratados com dexmedetomidina (0,96 a 10 µg/kg) vomitaram, sendo a diferença entre os percentuais estatisticamente significativa 17. Em outro estudo, em 43% dos felinos submetidos ao tratamento com xilazina (0,36 a 0,64 mg/kg) e 58% dos que receberam dexmedetomidina (6 a 18 µg/kg) houve indução ao vômito, mas sem que houvesse diferença estatística entre os percentuais observados 27.
Embora o vômito produzido pelos agentes alfa-2 agonistas possa ser visto como efeito adverso, no contexto de sua utilização como medicação pré-anestésica ele pode ser interessante, por promover o esvaziamento gástrico e evitar complicações operatórias em um animal com jejum inadequado 6,18. Uma grande vantagem dos agonistas alfa-2 adrenérgicos é a disponibilidade de agentes reversores dos efeitos sedativos e analgésicos, que são indesejados quando o único objetivo é atingir o vômito. Ioimbina e atipamezol vêm sendo utilizados com essa finalidade 17,18,27,32.
O butorfanol, quando utilizado concomitantemente à dexmedetomidina, reduziu a frequência de vômitos em comparação aos animais que receberam somente o alfa-2 agonista 30. Essa informação pode ser levada em conta quando se deseja minimizar o vômito causado pela dexmedetomidina ou quando se observa falta de eficácia emetogênica em animais tratados com butorfanol.
Outros agentes
Os opioides são conhecidos por seu potencial efeito emetogênico. O mecanismo pelo qual eles induzem o vômito é a estimulação de receptores de dopamina na zona de gatilho dos quimiorreceptores 6,33. Dentre os opioides, a apomorfina e a morfina foram estudadas com essa finalidade, embora o vômito possa ocorrer por meio do uso de outros fármacos da mesma categoria. Doses baixas de morfina (0,1 mg/kg) associada a dexmedetomidina (20 µg/kg) já foram utilizadas para induzir o vômito em gatos 21,31, não se podendo definir o papel isolado de cada medicamento no efeito farmacológico, pois eles não foram empregados separadamente. Contudo, doses mais altas de morfina produzem um efeito antiemético 33. A apomorfina, um clássico indutor de vômito em cães, falhou em induzir o vômito em gatos na dose de 0,04 mg/kg pela via intravenosa 20. Talvez a via de administração possa interferir no efeito emético dos opioides em felinos, como apontado em um estudo com hidromorfona, que revelou que a via subcutânea de administração estava associada a maior taxa de vômitos que as vias intravenosa e intramuscular 34.
O xarope de ipeca (ou ipecacuanha) é um medicamento antigo não mais recomendado na medicina humana e que contém o alcaloide emetina, uma substância com reconhecido efeito emético 35. Aparentemente, o xarope de ipeca atua centralmente e em particular no trato gastrintestinal, onde induz irritação da mucosa gástrica 6,35. Em cães, o xarope de ipeca na dose de 0,5 mL/kg mostrou-se um bom indutor de vômito 36, porém o mesmo efeito não foi observado em gatos 20. Além disso, os animais permaneceram anoréticos e relutantes à manipulação por vários dias após uma única dose 20. A baixa eficácia emética, os efeitos adversos e um possível impacto negativo do conteúdo gástrico na irritação da mucosa parecem não justificar a utilização do xarope de ipeca em condições clínicas 6,20.
Antieméticos
Metoclopramida
A metoclopramida é um agente dopaminérgico que inibe o vômito por ação em receptores dopaminérgicos do tipo 2 na ZGQR 3,6,9. Esse fármaco é um dos mais antigos agentes antieméticos, e sua eficácia é conhecida em cães, em particular quando mecanismos humorais (ou periféricos indiretos) estão envolvidos. Contudo, em gatos o efeito parece não ser o mesmo, conforme os estudos citados a seguir.
A injeção intraventricular cerebral de dopamina em gatos provou que ela é um neurotransmissor capaz de induzir o vômito 37. Esse vômito não foi prevenido pela administração intraventricular prévia de antagonistas dopaminérgicos como metoclopramida, domperidona e clorpromazina, entre outros; no entanto, foi prevenido pela utilização de antagonistas adrenérgicos 37. Em outro estudo, a apomorfina, um agonista de receptores dopaminérgicos do tipo 2, não induziu o vômito quando utilizada por via parenteral 38. Esses fatos mostram que o efeito emético da dopamina em gatos parece depender da liberação de neurotransmissores adrenérgicos com ação em receptores alfa-2 37 – daí possivelmente a falta de eficácia antiemética da metoclopramida e a capacidade de os agonistas alfa-2 adrenérgicos (dexmedetomidina e xilazina) induzirem o vômito na espécie felina.
Nesse cenário, dois estudos avaliaram a capacidade de a metoclopramida impedir o vômito causado pela injeção de xilazina. Em um deles, doses de 0,4 mg/kg de metoclopramida pela via intramuscular não impediram que os gatos vomitassem após uma dose alta de xilazina de 2 mg/kg pela mesma via 39. Em outra pesquisa, doses de 0,2 a 1 mg/kg de metoclopramida foram eficazes ao bloquear o vômito em animais que receberam uma dose única de 0,66 mg/kg de xilazina, verificando-se tendência de maior efeito antiemético com a dose de 1 mg/kg 26. A contradição entre esses resultados pode ser explicada pelas diferentes doses de xilazina e metoclopramida empregadas nos estudos. Em adição, sabe-se que a metoclopramida, assim como outros antagonistas dopaminérgicos, pode ter efeito antisserotoninérgico, em particular sob doses elevadas 6,9,40, ou seja, sua ação estaria relacionada não apenas ao bloqueio de dopamina, mas também ao de serotonina na ZGQR ou no centro emético.
As doses de metoclopramida para gatos disponíveis na literatura variam de 0,1 a 0,5 g/kg a cada 6 a 8 h pelas vias subcutânea, intramuscular ou oral 6,9,40-42, sendo a dose de 0,2 a 0,5 mg/kg a cada 6 a 8 h a mais comumente citada 6,41,42.
A despeito da falta de estudos de eficácia convincentes, aponta-se algum resultado clínico da metoclopramida em certos casos. Possivelmente o efeito pró-cinético contribua para a aceleração do esvaziamento gástrico e, por conseguinte, para o controle do vômito 6,9,40-42. Doses mais altas de metoclopramida são associadas a sintomas extrapiramidais em cães e gatos, sendo desencorajadas 9,41.
Ondansetrona
A ondansetrona é um antagonista de receptores 5-HT3 encontrados no CE, na ZGQR e no trato gastrintestinal. Estudos mostram que após quimioterapia e injúria gastrintestinal ocorre liberação de serotonina, que pode provocar o vômito a partir do trato gastrintestinal (via periférica direta) ou mediante ativação, via circulação sistêmica, de receptores presentes na ZGQR (via periférica indireta) 3,42,43. O efeito da ondansetrona está relacionado ao bloqueio de receptores 5-HT3, com destaque para os presentes no trato gastrintestinal, uma vez que o fármaco, sob condições normais, não atravessa a barreira hematoencefálica 44. Vários estudos em medicina humana têm demonstrado amplamente a eficácia dessa categoria de medicamentos no controle do vômito após quimioterapia; em felinos, a evidência dessa eficácia é muito menor. Em dois estudos experimentais, a zacoprida, um antagonista de receptores 5-HT3, foi capaz de prevenir o vômito induzido pela administração de cisplatina em felinos 45,46.
Em seguida à administração oral, subcutânea ou intravenosa, a ondansetrona é metabolizada pelo fígado, sendo convertida parcialmente a dolasetrona, que é reduzida posteriormente a hidrodolasetrona, ambas com ação antiemética 6,47. Em seres humanos, inclusive, atribui-se uma afinidade 50 vezes maior da hidrodolasetrona por receptores 5-HT3 que a da dolasetrona 48. A farmacocinética da ondansetrona em gatos tem sido alvo de estudos recentes. A biodisponibilidade e a meia-vida de eliminação são mais adequadas pela via subcutânea (75% e 3,17 ± 0,53 h) que por via oral (32% e 1,18 ± 0,27 h); pela via intravenosa, a meia-vida de eliminação é de 1,84 ± 0,58 h 49. Em pacientes com doença hepática, a depuração da ondansetrona foi mais lenta que em gatos geriátricos, resultando em maior exposição ao fármaco 50. Por fim, uma tentativa de fornecer ondansetrona misturada a um gel pela via transdérmica (4 mg na face interna do pavilhão auricular) em felinos falhou, pois não se obtiveram níveis plasmáticos relevantes após doses únicas ou consecutivas 51.
Em que pese a ampla utilização dos inibidores de serotonina como primeira linha para o controle de vômito em seres humanos, as pesquisas em gatos ainda são muito esporádicas, com poucos estudos de eficácia e segurança publicados. Na dose de 0,22 mg/kg, a ondansetrona foi capaz de reduzir a frequência de vômitos em gatos tratados com dexmedetomidina e buprenorfina, mas apenas quando administrada no mesmo momento da medicação pré-anestésica 21. Em oposição, quando doses de dolasetrona de 0,8 mg/kg foram empregadas pelas vias subcutânea ou intravenosa, houve rápida metabolização da dolasetrona em hidrodolasetrona, e não se observou controle do vômito quando felinos foram desafiados com uma dose de 0,44 mg/kg de xilazina 47.
As doses de ondansetrona em felinos são muito mais baseadas em extrapolações da medicina humana que em estudos controlados para determinação de dose com modelos apropriados de indução de vômito. A recomendação de 0,5 a 1 mg/kg 30 minutos antes da utilização de quimioterápicos em felinos é tradicional 9, e pode-se manter o tratamento com doses de 0,5 a 1 mg/kg a cada 12 h pelas vias subcutânea ou oral 9,40,42,43. Mesmo com a falta de estudos, a ondansetrona é considerada um fármaco seguro em cães e gatos 40-42.
Maropitant
A substância P é um neurotransmissor com várias funções, incluindo mediação do vômito e da dor, e exerce seu efeito ao ligar-se a receptores de neurocinina do tipo 1 (NK1) no sistema nervoso central 52,53. O maropitant é um fármaco que bloqueia os receptores de NK-1 encontrados no CE e na ZGQR 6,9. Como o CE tem papel central no controle do vômito, pois recebe impulsos provenientes de outras áreas do cérebro, incluindo a ZGQR, o maropitant pode ser considerado um agente antiemético de amplo espectro 9. Em um modelo experimental, após uma única dose oral de 1 mg/kg para felinos, a biodisponibilidade foi de 50%, e o pico de concentração máxima (156 ng/mL) ocorreu após 2 a 3 h 20. Por via subcutânea, a mesma dose de 1 mg/kg foi completamente absorvida (biodisponibilidade relativa de 117%) em 0,5 h a 2 h, obtendo-se concentrações máximas de 269 ng/mL 20. As meias-vidas de eliminação por via oral e a subcutânea em gatos foram, respectivamente, de 13,1 h e 17,1 h, o que permite a utilização do maropitant a cada 24 h. Doses muito superiores à dose terapêutica de 1 mg/kg, variando de 0,5 a 5 mg/kg, mostraram-se seguras quando administradas por via subcutânea a cada 24 h por 15 dias consecutivos, não se observando alterações clínicas, hematológicas e bioquímicas relevantes nos felinos tratados com quaisquer doses 20. O maropitant é o fármaco com o maior número de estudos de eficácia antiemética em felinos. Quando utilizado 2 h antes de um desafio com xilazina (0,44 mg/kg), a redução nos vômitos em relação a um grupo de controle foi de 76,4%, 90% e 100% pelas vias subcutânea, oral e intravenosa, respectivamente 20. No mesmo estudo, o uso do maropitant por via oral 24 h antes do desafio também foi adequado ao reduzir em 66% a frequência de vômitos. Em gatos que receberam dexmedetomidina (20 µg/kg) e morfina (0,1 mg/kg) pela via intramuscular 20 h após o maropitant, apenas 1 em 32 animais vomitou (3,1%), em comparação a 20/34 (59%) dos animais do grupo de controle 19. Resultados favoráveis também foram obtidos em felinos desafiados com dexmedetomidina e morfina e que receberam o maropitant por via oral (dose fixa de 8 mg/gato, média de 2,9 ± 0,6 mg/kg) 2 h a 2,5 h antes da injeção. Houve diferença estatisticamente significativa entre os grupos tratados com maropitant e os grupos de controle em relação à frequência de vômitos (13% x 32%, respectivamente) e mímicas de vômito, ou seja, sem a expulsão de conteúdo (13% e 36%, respectivamente) 31. Ainda nesse estudo, a frequência de sialorreia e lambedura labial, que podem ser indicativos de náusea, não foi reduzida pelo maropitant.
Em felinos com doença renal crônica (categorias II a III conforme a International Renal Interest Society – Iris), o uso de maropitant por via oral na dose de 4 mg por gato (média de 1,1 mg/kg, 0,6 a 2,9 mg/kg) por 14 dias reduziu significativamente a frequência de vômitos, sem alterar escores de apetite, atividade, peso e concentrações séricas de creatinina 54. O maropitant também eliminou a ocorrência de vômitos em gatos que receberam por via oftálmica brimonidina, um agente alfa-2 adrenérgico conhecido por provocar sedação e vômitos 55.
Por fim, provou-se a eficácia do maropitant em um modelo experimental de enjoo de movimento semelhante ao de uma roda-gigante. Os gatos tratados com a dose subcutânea de 1 mg/kg 4 h antes de participar do modelo não vomitaram e tiveram escores de náusea menores, apesar de apresentarem uma tendência maior de mímica de vômito que os animais não tratados 20.
A utilização de maropitant em felinos não é aprovada em todos os países. Nos Estados Unidos, a apresentação injetável do produto está indicada para a espécie na dose de 1 mg/kg (a mesma testada na grande maioria dos estudos) pelas vias subcutânea ou intravenosa (bolus em 1 a 2 min) a cada 24 h por até 5 dias consecutivos 56. Há relatos de desconforto devido à aplicação do maropitant injetável pela via subcutânea, conforme explicitado em um estudo no qual gatos tratados com esse antiemético apresentaram escores de alteração de comportamento – medidos por uma escala analógica visual em que 0 representa ausência de alteração e 10 alteração importante – significativamente maiores que as pontuações dos gatos que receberam solução salina (gatos com EAV ≥ 7: 27,3% para o grupo de maropitant e 4% para o grupo de controle) 19. Os sintomas apresentados foram vocalização e tentativas de escapar à contenção manual, sendo, no conjunto, considerados como parte de um comportamento aversivo após a injeção 19.
Um estudo em cães mostrou que a dor provocada pela injeção é proporcional ao aumento da fração livre do maropitant. Essa dor pode ser minimizada pela manutenção do produto sob refrigeração (2 a 8 ºC), já que em temperaturas baixas há maior ligação do maropitant com um excipiente chamado sulfobutiléter-β-ciclodextrina, e essa ligação resulta em menor fração livre do maropitant, havendo assim diminuição da dor 57.
Mirtazapina
A mirtazapina, medicamento empregado como agente estimulante de apetite em felinos, tem efeito antiemético complementar. Seu mecanismo de ação é complexo e envolve o bloqueio pré-sináptico de receptores alfa-2 adrenérgicos (com aumento de transmissões noradrenérgica e serotoninérgica) e o bloqueio não seletivo de receptores de serotonina 42. Onze pacientes com doença renal crônica foram tratados com mirtazapina (1,88 mg/animal) a cada 48 h, por via oral, ao longo de 3 semanas 58. Nesse estudo observou-se que, além da melhora no apetite, os gatos tratados tiveram frequência de vômitos inferior à apresentada por animais não tratados. Supõe-se que o resultado esteja relacionado ao efeito antisserotoninérgico no sistema nervoso central mediado pelo bloqueio indistinto de receptores 5-HT1, 5-HT2 e 5-HT3, fato que se opõe ao bloqueio da ondansetrona, específica para 5-HT3 6,9,42.
Por outro lado, doses mais altas de mirtazapina estiveram associadas a vômito em uma série de relatos de sobredose em felinos 59. Entre os 84 animais avaliados, o vômito ocorreu em 26,2% dos casos, sendo um dos dez sintomas mais frequentes de sobredose. A dose média dos animais que apresentaram vômitos foi de 2,92 mg/kg (0,73-5,38 mg/kg), e a relevância da prescrição e da administração da dose correta pelo dono do animal foi enfatizada como uma necessidade nesse trabalho. Os sintomas de sobredose de mirtazapina são semelhantes aos observados em casos de síndrome serotoninérgica em gatos 60,61.
Em que pese a eficácia da mirtazapina, a via oral de administração limita seu uso em casos agudos, tornando-a um medicamento mais voltado para prevenção do vômito crônico. A dose de mirtazapina recomendada é de 1,88 g/gato a cada 24 h 9,42. Em felinos com doença renal crônica, a meia-vida de eliminação é mais longa (15,2 ± 4,2 h) que em animais saudáveis, justificando uma posologia a cada 48 58,62. O mesmo efeito de prolongamento de meia-vida foi observado em felinos com hepatopatias de natureza variada (mediana de 13,8 h, faixa de 7,9 h a 61,4 h), o que sugere que a frequência de administração nessa categoria de pacientes possa ser menor 63.
Outros antieméticos
Tranquilizantes fenotiazínicos (acepromazina, clorpromazina e proclorpromazina, entre outros) têm efeito antidopaminérgico e podem contribuir para o controle do vômito por meio do bloqueio de receptores D2 no CE e na ZGQR; alguns fenotiazínicos também têm efeito antimuscarínico e anti-histamínico 6,9,40. No entanto, essa categoria de medicamentos é utilizada por suas propriedades sedativas, sendo rara a utilização com objetivo antiemético primário. De forma geral, os anti-histamínicos (prometazina, difenidramina, dimenidrinato e ciclizina) contribuem para o controle do vômito em vista do bloqueio de receptores H1, em particular na ZGQR 6,9. São poucos os estudos de farmacocinética e eficácia dos anti-histamínicos em gatos, e, de modo similar aos fenotiazínicos, sua utilização preferencial relaciona-se a processos alérgicos. Em seres humanos, protocolos para prevenção do vômito com a utilização de dexametasona e antisserotoninérgicos são bastante utilizados 64-66. Mostrou-se que a dexametasona em felinos sob doses elevadas (4 e 8 mg/kg pela via intramuscular) foi capaz de impedir o vômito induzido pela xilazina (0,66 mg/kg, IM) quando injetada 1 h antes do alfa-2-agonista; doses de 1 e 2 mg/kg não foram eficazes 67. Em um estudo experimental, o mecanismo proposto para a eficácia antiemética foi a ativação de receptores de glicocorticoides e alfa-2 adrenérgicos no núcleo solitário do tronco encefálico 68.
Considerações finais
O vômito é um sintoma comum na clínica de felinos, e as estratégias farmacológicas de seu controle e prevenção predominam sobre as de indução. A evolução nos estudos de antieméticos trouxe informações importantes sobre a eficácia e a segurança de medicamentos, possibilitando entender particularidades fisiológicas inerentes à espécie felina e relacionar mecanismos de ação com receptores e seus neurotransmissores nas diferentes áreas do cérebro e no trato gastrintestinal. Além disso, mostra-se reiteradamente que os dados obtidos nos estudos em cães nem sempre são extrapoláveis para os gatos.
Em vista de sua excelente capacidade de promover sedação e analgesia, o uso progressivo dos agentes adrenérgicos alfa-2 agonistas em felinos tem proporcionado informações relevantes sobre o potencial emetogênico da categoria, que pode ser utilizado a favor de situações clínicas específicas.
A utilização relativamente recente de novos fármacos como o maropitant, inicialmente aprovado para cães, abriu caminho para se revisar a eficácia de fármacos mais antigos, como a metoclopramida, em gatos. Cabe ressaltar a necessidade de comprovação dos efeitos emetogênico ou antiemético de qualquer fármaco com base em estudos bem delineados e que se valham de modelos de indução de vômito adequados para a espécie em estudo neste trabalho.
A partir desses resultados, a expansão dos estudos de eficácia e segurança em um contexto de mundo real, com animais portadores de doença de ocorrência natural, pode fornecer resultados aplicáveis e mais confiáveis para o clínico.
Referências
01-GALLAGHER, A. Vomiting and regurgitation. In: ETTINGER, S. J. ; FELDMAN, E. C. ; CÔTÉ, E. Textbook of veterinary internal medicine: diseases of the dog and the cat. 8. ed. St. Louis: Elsevier, 2017. p. 158-163. ISBN: 978-0-323-46213-6.
02-DOSSIN, O. Diagnostic tools. In: STEINER, J. E. Small animal gastroenterology. 1. ed. Hannover: Schlutersche Verlagsgesellschaft mbH & Co., 2008. p. 3-114. ISBN: 978-3-89993-027-6.
03-WASHABAU, R. J. Vomiting. In: WASHABAU, R. J. ; DAY, M. J. Canine and feline gastroenterology. 1. ed. St. Louis: Elsevier Saunders, 2013. p. 167-173. ISBN: 978-1-4160-3661-6.
04-WILLARD, M. D. Clinical manifestations of gastrointestinal disorders. In: NELSON, R. W. ; COUTO, C. G. Small animal internal medicine. 6. ed. St. Louis: Elsevier, 2020. p. 389-411. ISBN: 978-0-323-57014-5.
05-HAUCK, S. R. ; GISSELMAN, K. ; CORDNER, A. ; NICHOLSON, A. G. Chronic vomiting in cats: etiology and diagnostic testing. Journal of the American Animal Hospital Association, v. 52, n. 5, p. 269-276, 2016. doi: 10.5326/JAAHA-MS-6290.
06-BOOTHE, D. M. Gastrointestinal pharmacology. In:___. Small animal clinical pharmacology an therapeutics. 2. ed. St. Louis: Elsevier Saunders, 2012. p. 672-744. ISBN: 978-0-7216-0555-5.
07-UENO, T. ; CHEN, J. D. Z. Vomiting and gastric electrical dysrhythmia in dogs. Scandinavian Journal of Gastroenterology, v. 39, n. 4, p. 344-352, 2004. doi: 10.1080/00365520310008601.
08-MILLER, A. D. ; RUGGIERO, D. A. Emetic reflex are revealed by expression of the immediate-early gene c-fos in the cat. The Journal of Neuroscience, v. 14, n. 2, p. 871-888, 1994. doi: 10.1523/JNEUROSCI.14-02-00871.1994.
09-PAPICH, M. G. Drugs for treating gastrointestinal diseases. In: RIVIERE, J. E. ; PAPICH, M. G. Veterinary pharmacology and therapeutics. 10. ed. Hoboken: John Wiley & Sons, 2018. p. 1245-1277. ISBN: 978-1118855829.
10-WICKHAM, R. J. Revisiting the physiology of nausea and vomiting – challenging the paradigm. Supportive Care in Cancer, v. 28, n. 1, p. 13-21, 2020. doi: 10.1007/s00520-019-05012-8.
11-LACY, B. E. ; PARKMAN, H. P. ; CAMILLERI, M. Chronic nausea and vomiting: evaluation and treatment. The American Journal of Gastroenterology, v. 113, n. 5, p. 647-659, 2018. doi: 10.1038/s41395-018-0039-2.
12-LEE, J. A. Emergency management and treatment of the poisoned small animal patient. The Veterinary Clinics of North America: Small Animal Practice, v. 43, n. 4, p. 757-771, 2013. doi: 10.1016/j.cvsm.2013.03.010.
13-LEE, J. A. Decontamination and detoxification of the poisoned patient. In: HOVDA, L. ; BRUTLAG, A. ; POPPENGA, R. H. ; PETERSON, K. Blackwell’s five-minute veterinary consult. Clinical companion – small animal toxicology. 2. ed. Ames: Wiley Blackwell, 2016. p. 3-18. ISBN: 978-1119036548.
14-PLUMB, D. C. Hydrogen peroxyde 3% (oral). In:___. Plumb’s Veterinary Drug Handbook. 9. ed. Hoboken: Wiley-Blackwell, 2018. p. 579-580. ISBN: 978-1-1193-4445-2.
15-KHAN, S. A. ; MCLEAN, M. K. ; SLATER, M. ; HANSEN, S. ; ZAWISTOWSKI, S. Effectiveness and adverse effects of the use of apomorphine and 3% hydrogen peroxide solution to induce emesis in dogs. Journal of the American Veterinary Medical Association, v. 241, n. 9, p. 1179-1184, 2012. doi: 10.2460/javma.241.9.1179.
16-Niedzwecki, A. H. ; Book, B. P. ; Lewis, K. M. ; Estep, J. S. ; Hagan, J. Effects of oral 3% hydrogen peroxide used as an emetic on the gastroduodenal mucosa of healthy dogs. Journal of Veterinary Emergency and Critical Care, v. 27, n. 2, p. 178-184, 2017. doi: 10.1111/vec.12558.
17-Thawley, v. j. ; Drobatz, K. J. Assessment of dexmedetomidine and other agents for emesis induction in cats: 43 cases (2009-2014). Journal of the American Veterinary Medical Association, v. 247, n. 12, p. 1415-1418, 2015. doi: 10.2460/javma.247.12.1415.
18-Rankin, D. C. Sedatives and tranquilizers. In: Grimm, K. A. ; Lamont, L. A. ; Tranquilli, W. J. Greene, s. a. ; Robertson, s. a. Veterinary anesthesia and analgesia. 5. ed. Ames: Wiley-Blackwell, 2015. p. 196-206. ISBN: 978-1-118-52623-1.
19-Martin-Flores, m. ; Sakai, D. M. ; Learn, M. M. ; Mastrocco, A. ; Campoy, l. ; Boesch, J. M. ; Gleed, R. D. Effects of maropitant in cats receiving dexmedetomidine and morphine. Journal of the American Veterinary Medical Association, v. 248, n. 11, p. 1257-1261, 2016. doi: 10.2460/javma.248.11.1257.
20-Hickman, M. A. ; Cox, S. R. ; Mahabir, S. ; Miskell, C. ; Lin, J. ; Bunger, A. ; McCall, R. B. Safety, pharmacokinetics and use of the novel NK-1 receptor antagonist maropitant (CereniaTM) for the prevention of emesis and motion sickness in cats. Journal of Veterinary Pharmacology and Therapeutics, v. 31, n. 3, p. 220-229, 2008. doi: 10.1111/j.1365-2885.2008.00952.x.
21-Santos, L. C. p. ; Ludders, J. W. ; Erb, H. N. ; Martin-Flores, M. ; Basher, K. L. Kirch, P. A randomized, blinded, controlled trial of the antiemetic effect of ondansetron on dexmedetomidine-induced emesis in cats. Veterinary Anaesthesia and Analgesia, v. 38, n. 4, p. 320-327, 2011. doi: 10.1111/j.1467-2995.2011.00619.x.
22-Colby, E. D. ; McCarthy, L. E. ; Borison, H. L. Emetic action of xylazine on the chemoreceptor trigger zone for vomiting in cats. Journal of Veterinary Pharmacology and Therapeutics, v. 4, n. 2, p. 93-96, 1981, doi: 10.1111/j.1365-2885.1981.tb00716.x.
23-Duke, T. ; Cox, A. M. k. ; Remedios, A. M. ; CRIBB, P. H. The cardiovascular effects of placing fentanyl or medetomidine in the lumbosacral epidural space of isoflurane-anaesthetized cats. Veterinary Surgery, v. 23, n. 2, p. 149-155, 1994. doi: 10.1111/j.1532-950x.1994.tb00460.x.
24-Hikasa, Y. ; Takase, K. ; Ogasawara, S. Evidence for the involvement of α2-adrenoceptors in the emetic action of xylazine in cats. American Journal of Veterinary Research, v. 50, n. 8, p. 1348-1351, 1989.
25-Hikasa, y. ; Akiba, T. ; Iino, Y. ; Matsukura, M. ; Takase, K. Ogasawara, S. Central alpha-adrenoceptor subtypes involved in the emetic pathway in cats. European Journal of Pharmacology, v. 229, n. 2-3, p. 241-251, 1992. doi: 10.1016/0014-2999(92)90562-i.
26-Kolahian, S. ; Jarolmasjed, S. Effects of metoclopramide on emesis in cats sedated with xylazine hydrochloride. Journal of Feline Medicine and Surgery, v. 12, n. 12, p. 899-903, 2010. doi: 10.1016/j.jfms.2010.06.008.
27-Willey, J. L. ; Julius, T. M. ; Claypool, S. P. A. Clare, M. C. Evaluation and comparison of xylazine hydrochloride and dexmedetomidine hydrochloride for the induction of emesis in cats: 47 cases (2007-2013). Journal of American Veterinary Medical Association, v. 248, n. 8, p. 923-928, 2016. doi: 10.2460/javma.248.8.923.
28-Tranquilli, W. J. ; Thurmon, J. C. ; Benson, G. J. Alterations in epinephrine-induced arrhythmogenesis after xylazine and subsequent yohimbine administration in isoflurane anaesthetized dogs. American Journal of Veterinary Research, v. 49, n. 7, p. 1072-1075, 1988.
29-Guo, T. Z. ; Tinklenberg, J. ; Oliker, R. ; Maze, M. Central alpha1-adrenoreceptor stimulation functionally antagonizes the hypnotic response to dexmedetomidine, an alpha 2-adrenoreceptor agonist. Anesthesiology, v. 75, n. 2, p. 252-256, 1991. doi: 10.1097/00000542-199108000-00013.
30-Papastefanou, A. K. ; Galatos, A. D. ; Pappa, E. ; Lymperis, A. G. ; Kostoulas, P. The effect of butorphanol on the incidence of dexmedetomidine-induced emesis in cats. Veterinary Anaesthesia and Analgesia, v. 42, n. 6, p. 608-613, 2015. doi: 10.1111/vaa.12260.
31-Martin-Flores, M. ; Mastrocco, A. ; Lorenzutti, A. M. ; Campoy, L. ; Kirch, P. Stone, M. Learn, M. M. ; Boesch, J. M. Maropitant administered orally 2-2.5 h prior to morphine and dexmedetomidine reduces the incidence of emesis in cats. Journal of Feline Medicine and Surgery, v. 19, n. 8, p. 876-879, 2017. doi: 10.1177/1098612X16663595.
32-Hassen, K. M. ; Posner, L. P. ; Campbell, N. B. The effect of aquapuncture at Pericardium 6 (PC-6) on dexmedetomidine-induced nausea and vomiting in cats. Veterinary Anaesthesia and Analgesia, v. 46, n. 3, p. 308-314, 2019. doi: 10.1016/j.vaa.2019.01.004.
33-KUKANICH, B. ; WIESE, A. J. Opioids. In: Grimm, K. A. ; Lamont, L. A. ; Tranquilli, W. J. Greene, s. a. ; Robertson, s. a. Veterinary anesthesia and analgesia: the fifth edition of Lumb and Jones. 5. ed. Ames: Wiley-Blackwell, 2015. p. 207-226. ISBN: 978-1-118-52623-1.
34-Robertson, S. A. ; Wegner, K. ; Lascelles, B. D. X. Antinociceptive and side-effects of hydromorphone after subcutaneous administration in cats. Journal of Feline Medicine and Surgery, v. 11, n. 2, p. 76-81, 2009. doi: 10.1016/j.jfms.2008.05.003.
35-Höjer, J. ; Troutman, W. G. ; Hoppu, K. ; Erdman, A. ; Benson, B. E. ; Mégarbane, B. ; Thanacoody, R. ; Bedry, R. ; Caravati, E. M. ; American Academy of Clinical Toxicology; European Association of Poison Centres and Clinical Toxicologists. Position paper update: ipecac syrup for gastrointestinal decontamination. Clinical Toxicology, v. 51, n. 3, p. 134-139, 2013. doi: 10.3109/15563650.2013.770153.
36-Sedlacek, H. S. ; Ramsey, D. S. ; Boucher, J. F. ; Eagleson, J. S. ; Conder, G. A. ; Clemence, R. G. Comparative efficacy of maropitant and selected drugs in preventing emesis induced by centrally or peripherally acting emetogens in dogs. Journal of Veterinary Pharmacology and Therapeutics, v. 31, n. 6, p. 533-537, 2008. doi: 10.1111/j.1365-2885.2008.00991.x.
37-Jovanović-Mićić, D. ; Samardzić, R. ; Beleslin, D. B. The role of alpha-adrenergic mechanisms within the area postrema in dopamine-induced emesis. European Journal of Pharmacology, v. 272. n. 1, p. 21-30, 1995. doi: 10.1016/0014-2999(94)00622-e.
38-KING, G. L. Animal models in the study of vomiting. Canadian Journal of Physiology and Pharmacology, v. 68, n. 2, p. 260-268, 1990. doi: 10.1139/y90-040.
39-TOPAL, A. ; GÜL, N. Y. Effects of dexamethasone, metoclopramide or acepromazine on emesis in cats sedated with xylazine hydrochloride. Acta Veterinaria Brno, v. 75, n. 2, p. 299-303, 2006. doi: 10.2754/avb200675020299.
40-TREPANIER, L. Acute vomiting in cats: rational treatment selection. Journal of Feline Medicine and Surgery, v. 12, n. 3, p. 225-230, 2010. doi: 10.1016/j.jfms.2010.01.005.
41-GERMAN, A. J. ; MADDISON, J. E. ; GUILFORD, G. Gastrointestinal drugs. In: MADDISON, J. E. PAGE, S. W. ; CHURCH, D. B. Small animal clinical pharmacology. 2. ed. Philadelphia: Saunders Elsevier, 2008. p. 469-497. ISBN: 978-0-7020-2858-8.
42-PAPICH, M. G. Saunders handbook of veterinary drugs: small and large animal. 4. ed. St. Louis: Elsevier, 2016. 928 p. ISBN: 978-0-323-24485-5.
43-WASHABAU, R. J. Antiemetic agents. In: WASHABAU, R. J. ; DAY, M. J. Canine & feline gastroenterology. 1. ed. St. Louis: Elsevier Saunders, 2013. p. 450-454. ISBN: 978-1-4160-3661-6.
44-Darmani, N. A. ; Ray, A. P. Evidence for a re-evaluation of the neurochemical and anatomical bases of chemotherapy-induced vomiting. Chemical Reviews, v. 109, n. 7, p. 3158-3199, 2009. doi: 10.1021/cr900117p.
45-Smith, W. L. ; Callaham, E. M. ; Alphin, R. S. The emetic activity of centrally administered cisplatin in cats and its antagonism by zacopride. Journal of Pharmacy and Pharmacology, v. 40, n. 2, p. 142-143, 1988. doi: 10.1111/j.2042-7158.1988.tb05202.x.
46-LUCOT, J. B. Blockade of 5-hydroxytryptamine3 receptors prevents cisplatin-induced but not motion- or xylazine-induced emesis in the cat. Pharmacology, Biochemistry, and Behaviour, v. 32, n. 1, p. 207-210, 1989. doi: 10.1016/0091-3057(89)90235-9.
47-Herndon, A. K. ; Quimby, J. M. ; Sieberg, L. G. ; Davis, L. ; Caress, A. L. ; Ligas, S. ; Hansen, R. J. ; Wittenburg, L. A. ; Gustafson, D. L. Preliminary pharmacokinetics of intravenous and subcutaneous dolasetron and pharmacodynamics of subcutaneous dolasetron in healthy cats. Journal of Feline Medicine and Surgery, v. 20, n. 8, p. 721-727, 2018. doi: 10.1177/1098612X17729310.
48-Balfour, J. A. ; Goa, K. L. Dolasetron. A review of its pharmacology and therapeutic potential in the management of nausea and vomiting induced by chemotherapy, radiotherapy or surgery. Drugs, v. 54, n. 2, p. 273-298, 1997. doi: 10.2165/00003495-199754020-00008.
49-Quimby, J. M. ; Lake, R. C. ; Hansen, R. J. ; Lunghofer, P. J. ; Gustafson, D. L. Oral, subcutaneous, and intravenous pharmacokinetics of ondansetron in healthy cats. Journal of Veterinary Pharmacology and Therapeutics, v. 37, n. 4, p. 348-353, 2014. doi: 10.1111/jvp.12094.
50-Fitzpatrick, R. L. ; Wittenburg, L. A. ; Hansen, R. J. ; Gustafson, D. L. ; Quimby, J. M. Limited sampling pharmacokinetics of subcutaneous ondansetron in healthy geriatric cats, cats with chronic kidney disease, and cats with liver disease. Journal of Veterinary Pharmacology and Therapeutics, v. 39, n. 4, p. 350-355, 2016. doi: 10.1111/jvp.12286.
51-Zajic, L. B. ; Herndon, A. K. ; Sieberg, L. G. ; Caress, A. L. ; Morgan, P. K. ; Hansen, R. J. ; Wittenburg, L. A. ; Gustafson, D. L. ; Quimby, J. M. Assessment of absorption of transdermal ondansetron in normal research cats. Journal of Feline Medicine and Surgery, v. 19, n. 12, p. 1245-1248, 2017. doi: 10.1177/1098612X16688807.
52-Schank, J. R. ; Heilig, M. Substance P and the neurokinin-1 receptor: the new CRF. International Review of Neurobiology, v. 136, p. 151-175, 2017. doi: 10.1016/bs.irn.2017.06.008.
53-Zieglgänsberger, W. Substance P and pain chronicity. Cell and Tissue Research, v. 375, n. 1, p. 227-241, 2019. doi: 10.1007/s00441-018-2922-y.
54-Quimby, J. M. ; Brock, W. T. ; Moses, K. ; Bolotin, D. ; Patricelli, K. Chronic use of maropitant for the management of vomiting and inappetence in cats with chronic kidney disease: a blinded, placebo-controlled clinical trial. Journal of Feline Medicine and Surgery, v. 17, n. 8, p. 692-697, 2015. doi: 10.1177/1098612X14555441.
55-Kanda, T. ; Toda, C. ; Morimoto, H. Shimizu, Y. ; Itoi, T. ; Furumoto, K. ; Okamura, Y. ; Iwata, E. Antiemetic effect of oral maropitant treatment before the administration of brimonidine ophthalmic solution in healthy cats. Journal of Feline Medicine and Surgery, n. 1098612X19862687, 2019. doi: 10.1177/1098612X19862687.
56-ZOETIS US. Cerenia. Bula do produto nos Estados Unidos. Zoetis Unites States, 2020. Disponível em <https://www.zoetisus.com/products/pages/cerenia/index.aspx>. Acesso em 4 de fevereiro de 2020.
57-Narishetty, S. T. ; Galvan, B. ; Coscarelli, E. ; Aleo, M. ; Fleck, T. Humphrey, W. ; McCall, R. B. Effect of refrigeration of the antiemetic Cerenia (maropitant) on pain on injection. Veterinary Therapeutics, v. 10, n. 3, p. 93-102, 2009.
58-Quimby, J. M. ; Lunn, K. F. Mirtazapine as an appetite stimulant and anti-emetic in cats with chronic kidney disease: a masked placebo-controlled crossover clinical trial. Veterinary Journal, v. 197. n. 3, p. 651-655, 2013. doi: 10.1016/j.tvjl.2013.05.048.
59-Ferguson, L. E. ; McLean, M. K. ; Bates, J. A. ; Quimby, J. M. Mirtazapine toxicity in cats: retrospective study of 84 cases (2006-2011). Journal of Feline Medicine and Surgery, v. 18, n. 11, p. 868-874, 2016. doi: 10.1177/1098612X15599026.
60-Pugh, C. M. ; Sweeney, J. T. ; Bloch, C. P. ; Lee, J. A. ; Johnson, J. A. ; Hovda, L. R. Selective serotonin reuptake inhibitor (SSRI) toxicosis in cats: 33 cases (2004-2010). Journal of Veterinary Emergency and Critical Care, v. 23, n. 5, p. 565-570, 2013. doi: 10.1111/vec.12091.
61-Indrawirawan, Y. ; McAlees, T. Tramadol toxicity in a cat: case report and literature review of serotonin syndrome. Journal of Feline Medicine and Surgery, v. 16, n. 7, p. 572-578, 2014. doi: 10.1177/1098612X14539088.
62-Quimby, J. M. ; Gustafson, D. L. ; Lunn, K. F. The pharmacokinetics of mirtazapine in cats with chronic kidney disease and in age-matched control cats. Journal of Veterinary Internal Medicine, v. 25, n. 5, p. 985-989, 2011. doi: 10.1111/j.1939-1676.2011.00780.x.
63-Fitzpatrick, R. L. ; Quimby, J. M. ; Benson, K. K. Ramirez, D. ; Sieberg, L. G. ; Wittenburg, L. A. ; Gustafson, D. L. In vivo and in vitro assessment of mirtazapine pharmacokinetics in cats with liver disease. Journal of Veterinary Internal Medicine, v. 32, n. 6, p. 1951-1957, 2018. doi: 10.1111/jvim.15237.
64-Vimolchalao, V. ; Sakdejayont, S. Wongchanapai, p. ; Sukprakun, S. ; Angspatt, P. ; Thawinwisan, W. ; Chenaksara, P. ; Sriuranpong, V. ; Vinayanuwatikun, C. ; Parinyanitikun, N. ; Poovorawan, N. ; Tanasanvimon, S. The efficacy and safety of the addition of olanzapine to ondansetron and dexamethasone for prevention of chemotherapy-induced nausea and vomiting in patients receiving highly emetogenic chemotherapy. International Journal of Clinical Oncology, v. 25, n. 2, p. 396-402, 2020. doi: 10.1007/s10147-019-01570-3.
65-Rajnikant, K. ; Bhukal, I. ; Kaloria, N. ; Soni, S. L. ; Kajal, K. Comparison of palonosetron and dexamethasone with ondansetron and dexamethasone to prevent postoperative nausea and vomiting in patients undergoing laparoscopic cholecystectomy. Anesthesia: Essays and Researches, v. 13, n. 2, p. 317-322, 2019. doi: 10.4103/aer.AER_21_19.
66-Thongrong, C. ; Chullabodhi, P. Kasemsiri, P. Kitkhuandee, A. ; Plailaharn, N. ; Sabangban, L. ; Jimarsa, T. Effects of intraoperative dexamethasone and ondansetron on postoperative nausea and vomiting in microvascular decompression surgery: a randomized controlled study. Anesthesiology Research and Practice, v. 2018, n. 6297362, 2018. doi: 10.1155/2018/6297362.
67-Ho, C. M. ; Ho, S. T. ; Wang, J. J. ; Lee, T. Y. ; Chai, C. Y. Effects of dexamethasone on emesis in cats sedated with xylazine hydrochloride. American Journal of Veterinary Research, v. 62, n. 8, p. 1218-1221, 2001. doi: 10.2460/ajvr.2001.62.1218.
68-Ho, C. M. ; Ho, S. T. ; Wang, J. J. ; Tsai, S. K. ; Chai, C. Y. Dexamethasone has a central antiemetic mechanism in decerebrated cats. Anesthesia and Analgesia, v. 99, n. 3, p. 734-739, 2004. doi: 10.1213/01.ANE.0000130003.68288.C7.


